
上海胤煌科技有限公司-傘棚燈,、不溶性微粒
 金牌會員
金牌會員 已認證
已認證


上海胤煌科技有限公司-傘棚燈,、不溶性微粒
 金牌會員
金牌會員 已認證
已認證
本總章與歐洲藥典和/或日本藥典的相應(yīng)文本一致,。這些藥典已承諾不對本協(xié)調(diào)章節(jié)進行任何單方面修改。本通用章節(jié)文本中屬于國家USP文本的部分,,因此不屬于協(xié)調(diào)文本的一部分,,用符號標(biāo)記(◆◆) 具體說明這一事實。
注射劑和非注射劑中的顆粒物由溶液中意外存在的外來可移動未溶解顆粒(氣泡除外)組成,。
◆如章節(jié)<1> Injections and Implanted Drug Products中所述,,通過肌肉或皮下途徑給藥的注射溶液必須滿足<788> Particulate Matter in Injections章節(jié)要求。這一要求已無限期推遲用于獸醫(yī)的產(chǎn)品,。包裝和標(biāo)記的專門用于腸外沖洗溶液不受<788>的顆粒物質(zhì)要求的限制,。放射性藥品制劑不受<788> Particulate Matter in Injections章節(jié)的限制。凡標(biāo)簽規(guī)定的在用藥前使用最終過濾器的非腸道產(chǎn)品,,均可不受<788> Particulate Matter in Injections的限制,,前提是有科學(xué)數(shù)據(jù)證明這一豁免是合理的。◆
對于顆粒物的測定,,下文規(guī)定了兩種方法,,即方法1(光阻法顆粒計數(shù)試驗)和方法2(顯微顆粒計數(shù)試驗)。當(dāng)檢查注射劑和腸外輸液中是否存在亞可見顆粒時,,最好使用方法1,。然而,可能有必要通過光阻法顆粒計數(shù)試驗和顯微顆粒計數(shù)試驗來測試某些制劑,,以得出符合要求的結(jié)論,。
并非所有的腸外制劑都能通過上述一種或兩種方法檢查亞可見顆粒。例如,,如果制劑的透明度降低或粘度增加,,方法1不適用時,則應(yīng)根據(jù)方法2進行試驗,。乳劑,、膠體和脂質(zhì)體制劑就是例子。類似地,,當(dāng)被吸入傳感器時產(chǎn)生空氣或氣泡的產(chǎn)品也可能需要進行顯微顆粒計數(shù)測試,。如果待測制劑的粘度足夠高,以致無法通過任何一種試驗方法對其進行檢查,,必要時需要使用適當(dāng)?shù)南♂寗┻M行定量稀釋,,以降低粘度,以便進行分析。
在檢查顆粒物的單個單元或單元組時獲得的結(jié)果不能確定地外推到其他未經(jīng)測試的單元,。因此,,如果要從觀測數(shù)據(jù)中得出有效的推論,以表征大量單元中顆粒物的水平,,就必須制定統(tǒng)計上合理的采樣計劃,。
◆就本章而言,小容量腸外注射劑是小容量注射劑的同義詞,,大容量腸外注射劑是大容量注射劑的同義詞,。◆
根據(jù)光阻原理,使用合適的儀器,,根據(jù)大小自動確定顆粒大小和顆粒數(shù)量,。Reagents, Indicators, and Solutions—Reagent Specifications章節(jié)中提供了無顆粒水的定義。
使用已知尺寸在10 μm到25 μm之間的球形顆粒的分散體校準儀器,。這些標(biāo)準顆粒分散在無顆粒水中,。分散過程中必須注意避免顆粒聚集。◆系統(tǒng)適用性可通過使用USP顆粒計數(shù)RS進行驗證,。◆
一般預(yù)防措施
試驗在限制顆粒物的條件下進行,,最好在層流柜中進行。
使用溫?zé)岬那鍧崉┤芤鹤屑毲逑此玫牟A髅蠛瓦^濾設(shè)備(膜式過濾器除外),,并用大量水沖洗,,以去除所有清潔劑痕跡。使用前,,用無顆粒水從上到下,、從外到內(nèi)沖洗設(shè)備。
注意不要將氣泡引入待檢查的制劑中,,尤其是在將制劑的部分轉(zhuǎn)移到要進行測定的容器中這個過程中,。為了檢查環(huán)境是否適合試驗,玻璃器皿是否正確清潔,,所用的水是否無顆粒,,應(yīng)進行以下試驗。根據(jù)下述方法,,測定五個無顆粒水樣品中的顆粒物,,每個樣品5 mL,。如果10 μm或更大粒徑的顆粒數(shù)量超過25個,,則為試驗采取的預(yù)防措施是不夠的。必須重復(fù)準備步驟,,直到環(huán)境,、玻璃器皿和水適合試驗。
方法
通過連續(xù)20次緩慢翻轉(zhuǎn)容器,混合樣品內(nèi)容物,。如有必要,,小心地拆下密封蓋。使用無顆粒水射流清潔容器開口的外表面,,并拆下封蓋,,避免內(nèi)容物受到任何污染。通過適當(dāng)?shù)拇胧┫龤馀?,例如靜置2分鐘或超聲波處理,。
對于大容量腸外注射劑,需要測試單個單元,。對于體積小于25 mL的小容量腸外注射劑,,將10個或更多單位的內(nèi)容物合并到一個清潔的容器中,以獲得25 mL的體積,;可通過混合適當(dāng)數(shù)量小瓶的內(nèi)容物,,并用無顆粒水稀釋至25 mL,或在無顆粒水不適用時,,用適當(dāng)?shù)臒o顆粒溶劑稀釋至25 mL,,制備試驗溶液。體積為25 mL或以上的小容量非腸道藥物可單獨進行試驗,。
非腸道使用的粉末用無顆粒水配置,,或當(dāng)無顆粒水不適用時,用適當(dāng)?shù)臒o顆粒溶劑重新配制,。
◆對于標(biāo)有“不用于直接輸注”的散裝包裝的非腸道用藥,,當(dāng)體積為25 mL或以上時,按照小容量非腸道用藥的說明進行,。計算與標(biāo)簽中給出的最大劑量相當(dāng)?shù)牟糠值脑囼灲Y(jié)果,。例如,如果散裝包裝的總體積為100 mL,,最大劑量體積為10 mL,,則每毫升的平均粒子數(shù)將乘以10,以獲得基于10 mL最大劑量的測試結(jié)果,。[注意,,計算測試結(jié)果時,考慮這個最大劑量部分相當(dāng)于一個完整容器的內(nèi)容,。]
應(yīng)根據(jù)容器容積的不同,,按照大容量或小容量腸外制劑的指示,制備和測試包裝有雙隔室(用于容納藥品和溶劑)的產(chǎn)品,。按照標(biāo)簽對每個單元進行混合,,活化和攪拌以確保單獨成分和藥物溶解徹底混合。◆
試樣數(shù)量必須足以提供統(tǒng)計上合理的評估。對于大容量腸外注射或體積大于等于25 mL的小容量腸外注射,,可使用適當(dāng)?shù)娜佑媱?,測試少于10個單位的樣品。
取四份樣品,,每份5 mL,,并計算尺寸等于或大于10 μm和25 μm的顆粒數(shù)。忽略第一份的結(jié)果,,并計算待檢查制劑的平均顆粒數(shù),。
評估
對于在標(biāo)稱體積超過100 mL的容器中提供的制劑,采用試驗1.A的標(biāo)準,。
對于在標(biāo)稱體積小于100 mL的容器中提供的制劑,,采用試驗1.B的標(biāo)準。
對于在標(biāo)稱體積為100 mL的容器中提供的制劑,,采用試驗1.B的標(biāo)準,。
[注:日本藥典中使用了試驗1.A。]
如果平均顆粒數(shù)超過限值,,則通過顯微顆粒計數(shù)測試對制劑進行測試,。
試驗1.A
標(biāo)稱含量超過 100 mL 的容器中的腸胃外輸注溶液或注射溶液:如果測試單位中存在的尺寸大于等于10 μm的粒子的平均顆粒數(shù)不超過 25個/mL,尺寸大于等于25 μm的粒子的平均顆粒數(shù)不超過 25個/mL,,則該制劑符合測試要求,。
試驗1.B
標(biāo)稱含量小于 100 mL 的容器的腸胃外輸注溶液或注射溶液:如果每個容器中存在的尺寸大于等于10 μm的粒子的平均顆粒數(shù)不超過 6000 個,尺寸大于等于25 μm的粒子的平均顆粒數(shù)不超過600個,,則該制劑符合測試要求,。
使用合適的雙目顯微鏡、用于保留顆粒物的過濾器組件和用于檢查的薄膜過濾器,。
將顯微鏡調(diào)整為100±10倍,,并配備一個用物鏡測微計校準的目鏡測微計、一個能夠容納并穿過薄膜過濾器整個過濾區(qū)域的機械工作臺,,以及兩個合適的照明器,,以提供除了傾斜照明之外的外場照明。
目鏡測微計是一個直徑為圓形的分劃器(見圖1),,由一個被十字準線分成四個象限的大圓,、100倍放大時直徑為10 μm和25 μm的透明和黑色參考圓以及以10 μm增量刻度的線性刻度組成。使用經(jīng)過國內(nèi)或國際標(biāo)準機構(gòu)認證的測微計對其進行校準,。分劃的線性刻度的相對誤差在±2%以內(nèi)是可以接受的,。大圓被指定為網(wǎng)格視場(GFOV)。
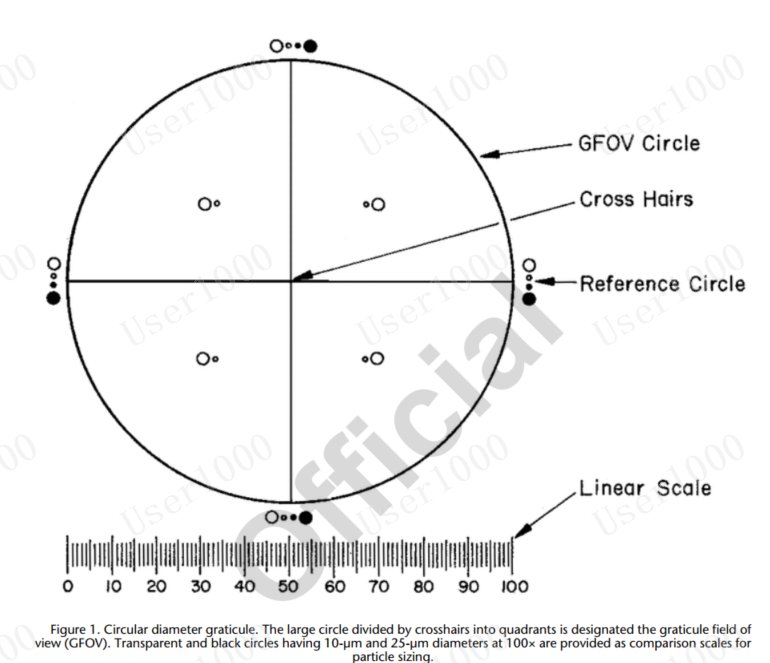
圖1,。圓直徑分劃,。被十字準線分成四個象限的大圓被指定為網(wǎng)格視場(GFOV)。提供了直徑為10μm和25μm的透明和黑色圓圈,,作為粒度測定的對比標(biāo)尺,。
需要兩個照明器。一個是顯微鏡內(nèi)部的一個主光場照明器,,另一個是一個外部的,、可聚焦的輔助照明器,可以調(diào)節(jié)以提供10°–20°角度的反射斜照明,。
用于保留顆粒物的過濾器組件包括由玻璃或其他合適材料制成的過濾器支架,,并配備有真空源和合適的膜過濾器。
膜過濾器尺寸合適,,顏色為黑色或深灰色,,無網(wǎng)格或有網(wǎng)格,標(biāo)稱孔徑為1.0 μm或更細,。
一般預(yù)防措施
試驗在限制顆粒物的條件下進行,,最好在層流柜中進行。
使用溫?zé)岬那鍧崉┤芤悍浅P⌒牡厍逑此玫牟A髅蠛瓦^濾器組件(膜式過濾器除外),,并用大量水沖洗,,以去除所有清潔劑痕跡。使用前,,用無顆粒水從上到下,、從外到內(nèi)沖洗膜過濾器和設(shè)備的兩側(cè)。
為了檢查環(huán)境是否適合試驗,,玻璃器皿和膜過濾器是否正確清潔,,所用的水是否無顆粒,應(yīng)進行以下試驗,。根據(jù)下述方法測定50 mL無顆粒水里的顆粒物,。如果過濾區(qū)域內(nèi)存在20個以上粒徑為10 μm或更大的顆粒,,或5個以上粒徑為25μm或更大的顆粒,則試驗所采取的預(yù)防措施是不夠的,。必須重復(fù)準備步驟,,直到環(huán)境,、玻璃器皿,、膜過濾器和水適合試驗。
方法
通過將容器連續(xù)緩慢翻轉(zhuǎn)20次來混合樣品內(nèi)容物,。如有必要,,小心地拆下密封蓋,。使用無顆粒水射流清潔容器開口的外表面,并拆下封蓋,,避免內(nèi)容物受到任何污染,。
對于大容量腸外注射劑,需要測試單個單元,。對于體積小于25 mL的小容量腸外注射,,將10個或更多單位的內(nèi)容物組合在一個清潔的容器中;可通過混合適當(dāng)數(shù)量小瓶的內(nèi)容物,,并用無顆粒水稀釋至25 mL,,或在無顆粒水不適用時,用適當(dāng)?shù)臒o顆粒溶劑稀釋至25 mL,,制備試驗溶液,。體積為25 mL或以上的小容量非腸道藥物可單獨進行試驗。
非腸道使用的粉末用無顆粒水配置,,或當(dāng)無顆粒水不適用時,,用適當(dāng)?shù)臒o顆粒溶劑重新配制。
試樣數(shù)量必須足以提供統(tǒng)計上合理的評估,。對于大容量腸外注射或體積大于等于25 mL的小容量腸外注射劑,,可使用適當(dāng)?shù)娜佑媱潱瑴y試少于10個單位的樣品,。
用幾毫升無顆粒水濕潤裝有薄膜過濾器的過濾器支架內(nèi)部,。將溶液池或單個樣品的所有溶液轉(zhuǎn)移到過濾漏斗中,并施加真空,。如果需要,,逐步添加一部分溶液,直到整個體積被過濾,。最后一次添加溶液后,,使用無顆粒水射流開始沖洗過濾器支架的內(nèi)壁。保持真空,,直到膜過濾器表面沒有液體,。將膜式過濾器放在有蓋培養(yǎng)皿中,讓過濾膜風(fēng)干,,蓋子稍微半開,。過濾膜干燥后,將皮氏培養(yǎng)皿放在顯微鏡臺上,,在照明設(shè)備的反射光下掃描過濾膜,,并計算尺寸等于或大于10 μm的顆粒數(shù)量和等于或大于25 μm的顆粒數(shù)量?;蛘?,允許通過計算部分過濾膜的計數(shù)來確定整體過濾膜的計數(shù),。計算待檢查制劑的平均顆粒數(shù)。
采用圓形直徑網(wǎng)格進行粒徑測定的過程是通過估算顆粒的等效直徑,,并與網(wǎng)格上的10 μm和25 μm參考圓進行比較,。因此,粒子不會從網(wǎng)格視場內(nèi)的初始位置移動,,也不會疊加在參考圓上進行比較。透明分劃參考圓的內(nèi)徑用于確定白色和透明粒子的大小,,而黑色粒子的大小則使用黑色不透明分劃參考圓的外徑,。
在進行微觀顆粒計數(shù)試驗時,不要試圖測量或列舉無定形,、半液體或其他形態(tài)不明顯的材料,,這些材料在過濾膜上會出現(xiàn)污漬或變色。這些材料表面很少或沒有起伏,,呈現(xiàn)膠狀或薄膜狀外觀,。在這種情況下,可通過光阻法計數(shù)方法測試溶液樣品來幫助解釋計數(shù),。
評估
對于在標(biāo)稱體積大于100 mL的容器中提供的制劑,,應(yīng)采用試驗2.A的標(biāo)準。對于在標(biāo)稱體積小于100 mL的容器中提供的制劑,,采用試驗2.B的標(biāo)準,。對于標(biāo)稱體積為100 mL的容器中提供的制劑,采用試驗2.B的標(biāo)準,。
[注:日本藥典中使用了試驗2.A]
試驗2.A
標(biāo)稱含量超過 100 mL 的容器中的腸胃外輸注溶液或注射溶液:如果測試單位中存在的尺寸大于等于10 μm的粒子的平均顆粒數(shù)不超過 12個/mL,,尺寸大于等于25 μm的粒子的平均顆粒數(shù)不超過2個/mL,則該制劑符合測試要求,。
試驗2.B
標(biāo)稱含量超過 100 mL 的容器中的腸胃外輸注溶液或注射溶液:如果測試單位中存在的尺寸大于等于10 μm的粒子的平均顆粒數(shù)不超過 3000個,,尺寸大于等于25 μm的粒子的平均顆粒數(shù)不超過300個,則該制劑符合測試要求,。
解決方案:
上海胤煌科技為注射劑中的不溶性微粒檢測提出了以下產(chǎn)品:
1,、 YH-LEIP-0201光阻法不溶性微粒分析儀

LEIP系列不溶性微粒檢測儀滿足各國藥典中光阻法檢測不溶性微粒的儀器要求,可直接檢測注射液,、無菌粉,、輸液器具及藥包材的不溶性微粒含量及大小。儀器采用高性能進口激光光源及補償電路,,保證各種無色,、有色樣品的測試精確度。進樣狹縫及管路采用進口316L及進口PTFE材料,,可直接檢測有機溶劑,、油基質(zhì)等特殊溶液,。
2、YH-MIP-0103顯微計數(shù)法不溶性微粒分析儀

技術(shù)優(yōu)勢:
√全自動的測試系統(tǒng),,自動掃描,、計數(shù)、出具報告,,減少人為操作的誤差
√全自動檢測系統(tǒng),,減少在使用過程中對測試人員眼睛的傷害
√可以區(qū)分顆粒性質(zhì),鑒別不溶性微粒的來源,,是金屬還是纖維
√符合中國藥典,、美國藥典、歐洲藥典,、日本藥典等各國藥典對于不溶性微粒檢查的要求,。
3、YH-MIP-0205 Pro全自動顯微計數(shù)法不溶性微粒分析儀

YH-MIP-0205 Pro全自動顯微計數(shù)法不溶性微粒分析儀是全新一代的不溶性微粒分析儀,,能夠以全自動的方式實現(xiàn)樣品中的不溶性微粒檢測,,可以完成自動過濾、干燥,、測試,、出具報告等多項流程;超分辨算法,、AI智能算法等多種圖像處理方式的引入,,能有效確保測試數(shù)據(jù)的準確性。符合中國藥典,、美國藥典,、歐洲藥典及日本藥典等各國藥典不溶性微粒檢查的儀器要求。
相關(guān)產(chǎn)品
更多
相關(guān)文章
更多
技術(shù)文章
2025-05-27技術(shù)文章
2025-05-20技術(shù)文章
2025-05-14技術(shù)文章
2025-05-12
虛擬號將在 秒后失效
使用微信掃碼撥號