
麥克默瑞提克(上海)儀器有限公司
 金牌會員
金牌會員 已認證
已認證

麥克默瑞提克(上海)儀器有限公司
 金牌會員
金牌會員 已認證
已認證
濕法造粒采用質量源于設計(QbD)的方法,要求制造商充分理解工藝變量之間的關系,,如粉體性能和設備設置,,以及最終產(chǎn)品的關鍵質量屬性(CQA),。制造商通過理解過程中的變量對最終顆粒特性的影響,以及它們對最終產(chǎn)品質量的影響,,從而開發(fā)出設計空間,。此外,強大的設計空間可以控制工藝變量,,來生成具有目標特性且有質量保證的片劑,。
了解濕法造粒過程中,工藝相關的綜合表征如何控制片劑的關鍵質量屬性,,能夠幫助定義口服固體制劑生產(chǎn)中所涉及的設計空間,。
用于QBD的動態(tài)表征
材料性能的變化以及工藝設置,為制造商提供了挑戰(zhàn)和機會,。材料本身批次之間可能存在差異,,因此理解材料在條件變化的生產(chǎn)過程中的行為,使得操作者能夠開發(fā)出設計空間進行運行,。
如果所使用的表征技術能夠提供可重復且可靠的結果,,并與具體的工藝條件相關聯(lián),那么在處理粉體時將挑戰(zhàn)轉化為機遇的能力將大大增強,。與許多其他已廣泛使用的粉體流動測試技術(如振實密度,、安息角和剪切單元)不同,動態(tài)測試方法模擬了典型的工藝條件,,從而提供了更易于影響最終產(chǎn)品質量的材料性能信息,。
評價濕顆粒
使用粉體流變儀進行動態(tài)測試,測量通過樣品時濕顆粒施加在槳葉上的阻力,,來評估濕顆粒的特性,。該阻力表示為“流動能”,通過直接測量槳葉穿過粉體時的旋轉扭矩和軸向作用力來計算,。
流動能受到許多特性的影響,,包括顆粒間摩擦和機械互鎖、毛細結合的強度和顆粒間的粘結作用,。在高剪切濕法造粒(HSWG)中,,添加水和功(剪切作用)得到更大、更致密,、更黏附的顆粒,,通常產(chǎn)生更高的流動能,,因為這些更大、更密的顆粒較難使用槳葉進行置換移動,,同時也更不易壓縮,。
流動能通常由基本流動能或BFE代表,也是固水比,、葉輪轉速和粘結劑溫度的函數(shù),,流動能與工藝設置之間的強大關系可確定關鍵工藝參數(shù)和設計空間。具有測試物料濕狀態(tài)下的能力,,確保盡早應用于生產(chǎn)工藝中,。
下面的案例研究展示了基于動態(tài)流動特性的成熟設計空間如何應用于濕法造粒過程,從而確定最終目標片劑的CQA,。
案例分析:通過顆粒質量定義濕法造粒
以下研究了定義非處方藥生產(chǎn)設計空間的兩個方面[1],。
首先,通過流變學性質定量研究了造粒機變量與所得顆粒質量之間的關系,。采用中試規(guī)格HSWG工藝制備顆粒,,然后研磨、添加潤滑劑,,使用流化床干燥機干燥,,最終制成片劑。HSWG步驟之后緊接著,,使用FT4粉體流變儀測量了濕顆粒的動態(tài),、整體和剪切特性。
研究第一階段的結果(圖1)表明,,通過對工藝參數(shù)的理解,,特別是固水比和葉輪轉速,可以預測濕顆粒的BFE,。因此,,通過調整這些參數(shù),操作者可以得到期望的BFE值,。
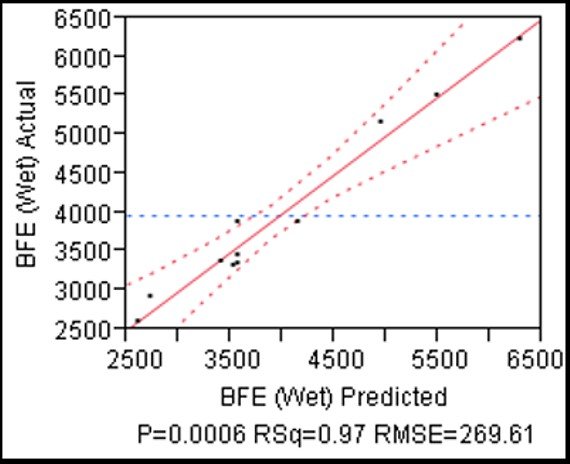
圖一:濕顆?;玖鲃幽埽˙FE)的實際與預測值
然后進行第二項研究以確定顆粒性質如何影響所得片劑的CQA。
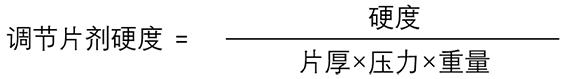
片劑硬度將取決于模具填充深度,、混合物透氣性和壓降,,而這些反過來又受到顆粒密度、流動特性,、壓縮性和運行速度等因素的影響,。為了分離出顆粒性能與片劑質量之間的關系,本研究采用調節(jié)片劑硬度來補償工藝參數(shù)的差異,。
分析壓片數(shù)據(jù)(圖2)可知,,濕顆粒BFE與調節(jié)硬度之間存在較強的相關性,。因此,結合兩項研究可知如何控制關鍵工藝參數(shù)來得到片劑的CQA,。
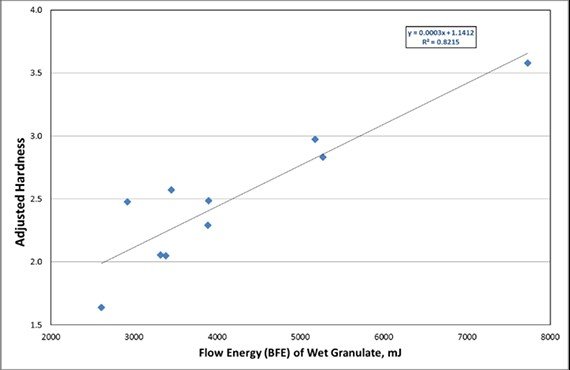
圖二:片劑硬度與濕顆粒BFE的關系
之前的研究也證明工藝變量與CQA之間的關系,,以及該方法如何應用于連續(xù)濕法造粒的過程[2]。
開發(fā)設計空間用于獲取CQA
從造粒到壓制的每一階段都必須有效地發(fā)揮作用,,才能生產(chǎn)出高質量的產(chǎn)品,。在生產(chǎn)過程中的任意時刻,不受控制的變量都可能導致產(chǎn)品缺陷和操作停機,。取得強大的設計空間,為操作人員提供了調整設置,、保證質量的機會,。在這個例子中,已證明濕顆粒的BFE與藥片的質量直接相關,。在充分理解相關材料性能和關鍵工藝參數(shù)的基礎上,,可采用QbD或設計空間方法進行單批造粒和片劑生產(chǎn),并將潛在的上游問題轉化為工藝性能和產(chǎn)品質量優(yōu)化的機會,。
Micromeritics在制藥領域提供多種解決方案,,為幫助廣大用戶學習了解相關應用,我們特別推出制藥應用主題網(wǎng)絡研討會,,5月19日14:00,,掃描下方二維碼,誠邀您的參與,!

參考文獻
[1] T. Freeman, P. Kishinevskaya, J. Huang , M. Moshgbar, John Yin, Evaluating the Design Space for the Batch Manufacture of an OTC Medicine, , Freeman Technology, Pfizer Inc.
[2] T. Freeman, A. Birkmire & B. Armstrong, A QbD Approach to Continuous Tablet Manufacture, Procedia Engineering, 102 (2015), pp443-449
相關產(chǎn)品
更多
相關文章
更多
技術文章
2025-04-28技術文章
2025-04-09技術文章
2025-03-31技術文章
2025-03-03