
上海奧法美嘉生物科技有限公司
 鉆石會員
鉆石會員 已認(rèn)證
已認(rèn)證

上海奧法美嘉生物科技有限公司
 鉆石會員
鉆石會員 已認(rèn)證
已認(rèn)證
本文隸屬于一體化解決方案系列,,全文共 4625字,閱讀大約需要 16分鐘
摘要:
為了避免可能對患者造成負(fù)面健康的后果,,應(yīng)盡量減少任何醫(yī)療設(shè)備帶來的顆粒污染,。有害顆粒所帶來的健康風(fēng)險取決于設(shè)備以及它們進入體內(nèi)的最終位置。進入靜脈系統(tǒng)的顆粒可能會引起靜脈炎,、肺肉芽腫,、局部組織梗塞和栓塞等,進而對人體造成傷害,。有些醫(yī)療器械實際上可能不會與血液接觸,,而最終可能會出現(xiàn)在身體的任何地方。在這種情況下,,醫(yī)療風(fēng)險取決于器械的放置位置以及顆粒的物理/化學(xué)性質(zhì),。非血管植入器械的一個主要問題是異物反應(yīng),這是一種可能導(dǎo)致纖維化,、炎癥以及裝置排斥的免疫反應(yīng),。考慮到這些風(fēng)險,,醫(yī)療器械制造商應(yīng)當(dāng)監(jiān)控并最大程度地減少顆粒污染,。
關(guān)鍵詞:醫(yī)療器械;顆粒污染,;AccuSizer 液體顆粒計數(shù)器; USP<788>
一,、標(biāo)準(zhǔn)
許多標(biāo)準(zhǔn)、指導(dǎo)文件以及信息報告為測試醫(yī)療器械上和來自醫(yī)療器械的顆粒污染提供了建議和要求,。這些文件涵蓋了從廣泛的指導(dǎo)到非常具體的測試要求以及通過/未通過標(biāo)準(zhǔn),。
AAMI TIR 42為測試、識別和制定血管器械顆粒污染限值的分析方法提供了指導(dǎo),。液體顆粒計數(shù)器和對過濾器上捕獲的顆粒進行顯微分析被認(rèn)為是潛在的測試技術(shù),,但沒有就最大允許顆粒計數(shù)的結(jié)論給出具體建議。相反,,它建議制造商應(yīng)根據(jù)顆粒的性質(zhì)和器械的臨床應(yīng)用設(shè)定自己的限值,。本文件確實參考了FDA測試支架和相關(guān)輸送系統(tǒng)的指導(dǎo)文件以及USP <788>中關(guān)于設(shè)置顆粒污染限值的建議。
用于自體輸血裝置的ANSI/AAMI標(biāo)準(zhǔn)AT6描述了一種用低顆粒水填充裝置的方法,。將水收集在膜過濾器上,,對纖維的微觀顆粒以及所有尺寸大于10μm的顆粒進行計數(shù)。
ISO標(biāo)準(zhǔn)8536-4: 2010描述了一次性重力輸液器和靜脈注射器械的測試過程和驗收標(biāo)準(zhǔn),?;緶y試過程是讓干凈的水流過10個器械,直到真空過濾器收集到500mL的水,。然后對過濾器進行顆粒計數(shù)并記錄圖1所示尺寸范圍內(nèi)的計數(shù),。
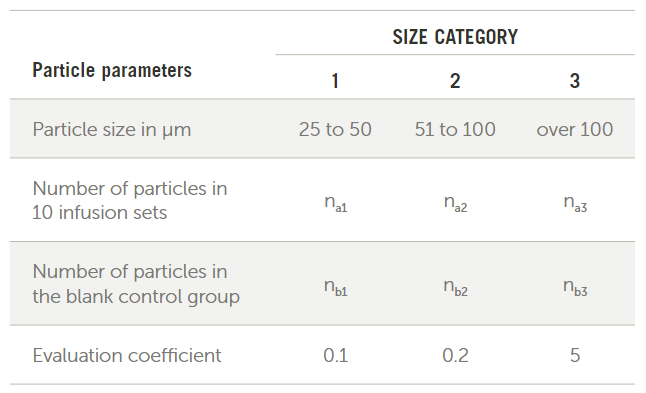
圖1. 出自ISO 8536
要計算零件是否通過,請將每個尺寸類別中的計數(shù)減去空白計數(shù)乘以評估系數(shù),。將這些值相加,,除以10,結(jié)果必須小于90。標(biāo)準(zhǔn)中給出的方程為:
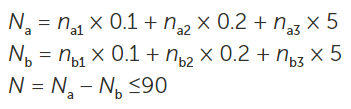
針對起搏器等有源植入式醫(yī)療器械的EN 45502和ISO 14708標(biāo)準(zhǔn)包括一項測試,,以幫助確保沒有不可接受的顆粒物釋放,。這里描述的測試包含將設(shè)備浸入裝有清潔液體的容器中,該液體的體積是設(shè)備表面積的五倍,。將容器在37℃的溫度下攪拌8–18小時,。將具有相同液體和應(yīng)力條件但沒有浸入式裝置的參考容器用作對照組。兩個容器中的液體均使用液體顆粒計數(shù)器進行測試,,設(shè)備計數(shù)減去參考容器計數(shù)必須低于圖2所示的濃度水平才能通過測試,。
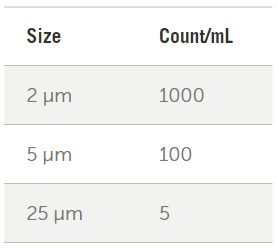
圖2. 出自ISO 14708-3
ASTM標(biāo)準(zhǔn)2394為構(gòu)建測試臺提供了指導(dǎo)框架,以模擬中等難度的扭曲程度
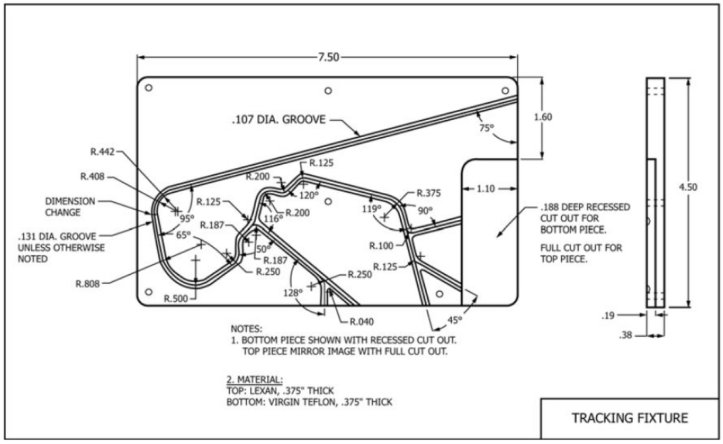
圖3. ASTM 2394的測試跟蹤固定裝置
若干已發(fā)布和起草的 FDA 指導(dǎo)文件為使用曲徑測試夾具測試支架時流出液體的顯微檢測提供了不具約束力的尺寸范圍建議,。
此測試的典型程序包括以下步驟:
1) 構(gòu)建如圖3所示的曲折路徑設(shè)備
2) 將鞘管放入板的凹槽中
3) 將測試導(dǎo)管穿過護套
4) 將支架引導(dǎo)至導(dǎo)管中
5) 將設(shè)備擴展到最大壓力或標(biāo)記直徑
6) 通過設(shè)備泵送清潔水
7) 將廢液留存在過濾器上
8) 對已獲取的顆粒進行顯微鏡計數(shù)
獲取到的顆粒應(yīng)出三個尺寸范圍的報告:≥10 μm,、≥25 μm,以及驗證測試產(chǎn)生>75%回收率的最大尺寸,。最大尺寸的下限應(yīng)>50 μm,。在采樣過程中必須將顆粒混合/懸浮,。驗證測試涉及將已知顆粒尺寸和計數(shù)的懸浮液引入測試臺和設(shè)備中,。已知濃度的樣品通過設(shè)備后,對流出物進行另一次顆粒計數(shù)測試,。流出物中的顆粒應(yīng)非常接近初始濃度,。在≥10和≥25μm的條件下回收率必須>90%,系統(tǒng)才能被視為通過驗證,。還要確定回收率> 75%時的尺寸上限,,以確定報告結(jié)果的第三個尺寸范圍。
雖然ASTM 2394和FDA指導(dǎo)文件的組合提供了構(gòu)建曲折路徑測試臺和要分析的尺寸范圍的詳細(xì)信息,,但沒有給出可接受的顆粒計數(shù)水平的建議,。器械制造商負(fù)責(zé)界定合理的界限范圍。
到目前為止,,本文檔中所討論的任何已被認(rèn)可的標(biāo)準(zhǔn)或指南都不適用于許多醫(yī)療器械,。在這種情況下,通常會參考美國藥典 <788> 關(guān)于亞可見顆粒的檢測方法,,以便在使用清水沖洗設(shè)備后對清潔度進行量化,。在沖洗設(shè)備之后,會使用諸如英特格(Entegris)公司的 AccuSizer SIS系統(tǒng)之類的液體顆粒計數(shù)器來對去除的顆粒進行分析,,如圖4

圖4. AccuSizer SIS 液體粒子計數(shù)
當(dāng)按照,;的操作流程,需對5mL的樣品進行四次測量,。第一次測量結(jié)果將被舍棄,然后對第二次至第四次的測量結(jié)果取平均值。針對大容量注射劑(LVI)所規(guī)定的允許濃度限值為:
25/mL ≥10μm
3/mL ≥25μm
使用美國藥典<788>中關(guān)于大容量注射劑(LVI)的限值時,,通過/不通過的判定標(biāo)準(zhǔn)是基于每毫升的顆粒濃度,。另一種方法是計算每個器械中的顆粒數(shù)量,然后采用美國藥典< 788 >中小容量注射劑(SVI)的標(biāo)準(zhǔn),,即:
6000 particle per device ≥10μm
600 particles per device ≥25μm
該程序用于測試應(yīng)特格(Entegris)Aramus?一次性袋子12,。在此過程中,將這些袋子裝滿清潔水,,放置在三維搖床上,,并攪拌設(shè)定的時長。所采用的程序如下:
1) 將袋子連接到測試系統(tǒng)管道
2) 用經(jīng)過0.45μm過濾器過濾的超純水沖洗工藝管線,,繞過一次性袋子(進行沖洗操作)
3) 將超純水通過0.45μm過濾器泵入一次性袋中
4) 使用3D搖桿攪拌袋子兩分鐘
5) 從廢水流中抽取兩個50 mL樣品進行USP<788>測試
6) 對下一個樣品重復(fù)上述步驟
同樣的程序可以應(yīng)用于多種醫(yī)療器械,。可以通過這個測試確定清除產(chǎn)品表面顆粒的最優(yōu)方法,,以應(yīng)用于其他器械,。這方式可以是使沖洗液流經(jīng)器械,亦或是將器械置于清水中并施加能量,,從而讓所有顆粒污染物釋放出,。
二、實驗:輸液器
使用Entegris的AccuSizer SIS液體顆粒計數(shù)器而非ISO 8536中描述的顯微鏡測定法,,對一次性輸液器進行了研究,。AccuSizer SIS計數(shù)器的動態(tài)范圍為0.5–400μm。該儀器通常用于各種USP測試,,包括USP <787>,、 <788>和<789>。圖5顯示了LE400傳感器的工作原理,,即穿過傳感器的顆粒會散射并遮蔽入射光和校準(zhǔn),,隨后借助校準(zhǔn)曲線將脈沖信號轉(zhuǎn)換為顆粒尺寸。
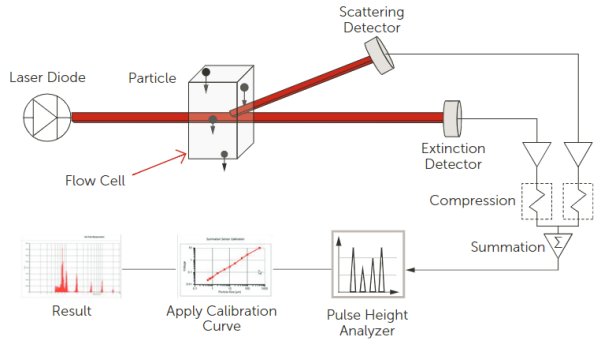
圖5. AccuSizer LE400傳感器的工作原理
2.1 流程
首先,,清潔500 mL瓶子,,并裝滿過濾后的去離子水,然后使用AccuSizer SIS儀器分析去離子水的顆粒尺寸和數(shù)量來確定背景計數(shù)(空白),。接下來,,經(jīng)過濾的去離子水在重力作用下流經(jīng)這些器械,并收集在潔凈的瓶子里,。原始結(jié)果以每毫升多少顆粒數(shù)的形式呈現(xiàn),,因此將報告結(jié)果乘以500以反映 500毫升中的總顆粒數(shù)。
所有測量均使用相同的測量方法:
1) 抽取0.5mL的皮重體積
2) 每次取5mL樣品進行測試,,共計4次
3) 舍棄第一個結(jié)果
4) 將第二到第四個結(jié)果取平均值
5) 結(jié)果以顆粒/mL為單位進行報告
該測量方法符合USP <788>,。結(jié)果以大于0.5,、2、5,、10,、25、50和100μm的粒徑范圍進行報告,。ISO 8536標(biāo)準(zhǔn)中未對25μm以下的尺寸做出要求,,且在最終計算中也不使用這些尺寸的數(shù)據(jù),但更小尺寸范圍的測量結(jié)果有助于量化輸液器清潔度之間的差異,,而這種差異在僅統(tǒng)計大于25μm的顆粒時是不容易被注意的,。
2.2 結(jié)果
空白計數(shù)的結(jié)果如圖6所示。注意,,當(dāng)粒徑大于10μm的時候,,其計數(shù)均為零。這意味著在最終計算中不需要進行空白扣除,。
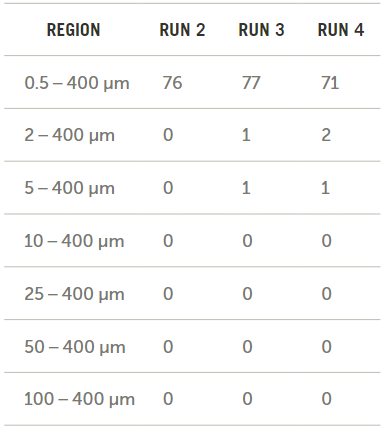
圖6. 空白背景計數(shù)
圖7展示了通過比較輸液器品牌B和輸液器品牌C所得到的以每毫升顆粒數(shù)形式的原始數(shù)據(jù)結(jié)果,。
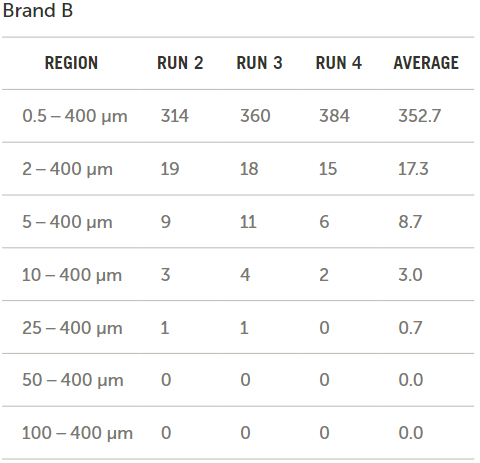
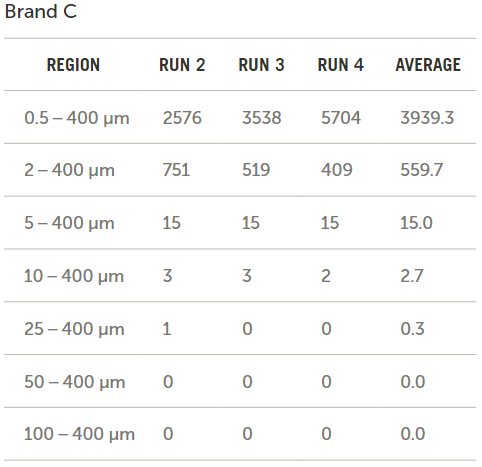
圖7. 品牌B和C原始數(shù)據(jù)的對比
按照ISO 8536中的說明,使用平均數(shù)據(jù)計算最終n值,。這些計算結(jié)果如圖8所示,。
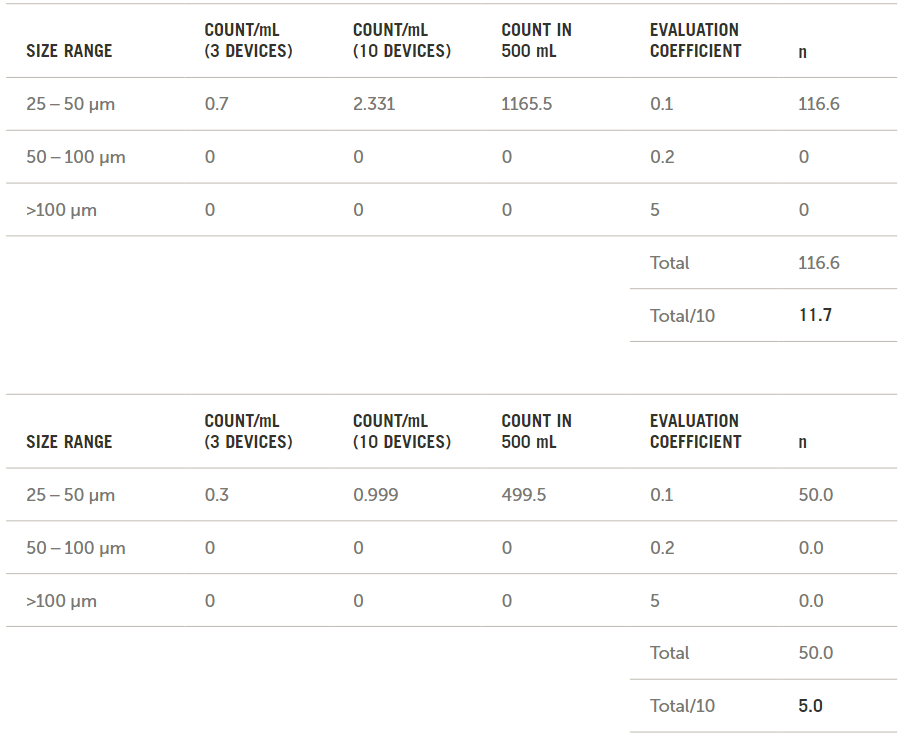
圖8. 根據(jù)ISO 8536計算的n值
本研究的方法驗證是依托于制備10μm和25μm的聚苯乙烯乳膠(PSL)標(biāo)準(zhǔn)品混合物進行的。對初始濃度進行了分析,,然后讓其在重力作用下流經(jīng)一套靜脈輸液器,,收集流經(jīng)后再次進行分析。圖9展示了以每毫升顆粒數(shù)為單位的初始樣品(藍(lán)色)和留存樣品(紅色)的分析結(jié)果,。
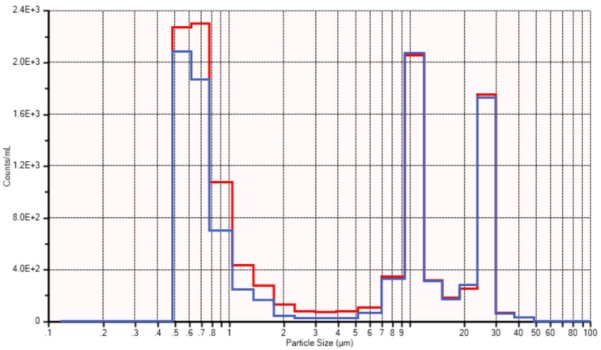
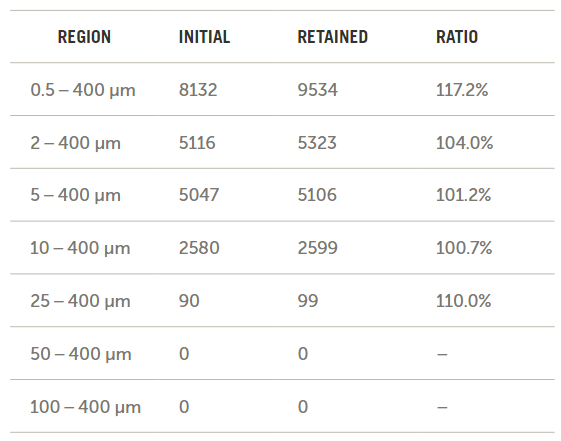
圖9. 顆粒滯留研究
盡管這份應(yīng)用筆記的作者擁有超過35年的粒度測量經(jīng)驗,,但此次滯留研究仍是一項艱巨的挑戰(zhàn),并且圖9中所展示的僅僅是最佳結(jié)果,。建議購買市面上可買到的顆粒計數(shù)標(biāo)準(zhǔn)品以推動這一流程,。
本研究中所檢測的輸液器非常干凈,很容易就通過ISO 8536標(biāo)準(zhǔn),。雖然顯微鏡檢測法的優(yōu)勢在于能夠更好地鑒別纖維,,但液體顆粒計數(shù)器檢測速度更快、操作更簡便,,并且能夠報告低至0.5μm的檢測結(jié)果,,通常能就相對清潔程度提供更多細(xì)節(jié)信息。
三,、實驗:腸內(nèi)營養(yǎng)袋
在這項研究中,,通過網(wǎng)絡(luò)購買了幾包容量為1200mL的腸內(nèi)營養(yǎng)輸送袋。盡管對于這些特定的醫(yī)療設(shè)備并沒有相關(guān)標(biāo)準(zhǔn)或限制,,但所購買的產(chǎn)品包括靜脈輸液(IV)型袋以及輸送裝置,,這為顆粒污染檢測提供了一種成本低廉且具有代表性的輸送系統(tǒng),。對這些設(shè)備采用了與輸液器類似的測試程序。首先通過對過濾后的去離子水和瓶子進行測試,,來建立一個干凈的背景環(huán)境,。將這些袋子里裝滿了1000mL的清潔水,,在重力作用下讓水依次流經(jīng)整個設(shè)備,,然后將水收集在一個潔凈的瓶子里。按照USP<788>的操作規(guī)程,,在AccuSizer SIS系統(tǒng)上對收集到的水進行了分析,,即測量四批5mL的樣品,然后計算并報告第二次到第四次測量所得的每毫升顆粒濃度,。
干凈水和瓶子的結(jié)果如圖10所示,。由于不存在>10 μm的顆粒,因此其他實驗不需要扣除背景,。
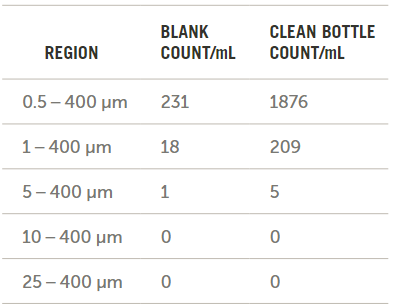
圖10. 空白瓶和干凈瓶中的顆粒計數(shù)
流經(jīng)三個袋子和輸送系統(tǒng)后所收集到的流出物的顆粒濃度結(jié)果(以每毫升的顆粒數(shù)表示)如圖11所示,。然后將袋子1重新裝滿水并手動攪拌,以確定通過施加額外能量來去除袋子表面的顆粒是否會增加流出物的顆粒計數(shù),。
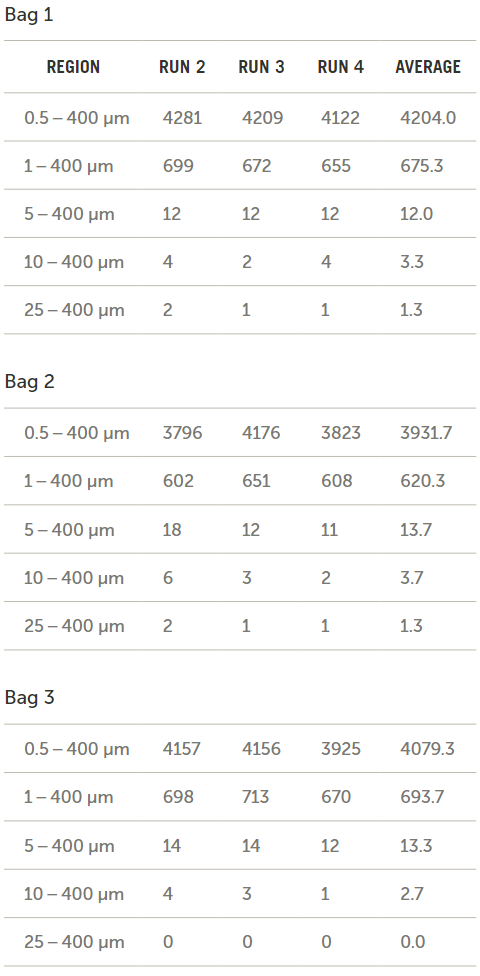
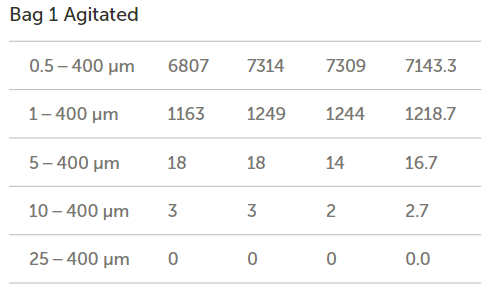
圖11. 腸內(nèi)營養(yǎng)袋中的顆粒計數(shù)
AccuSizer SIS軟件能夠自動報告USP<788>中大容量注射劑的合格/不合格標(biāo)準(zhǔn),,如圖12中針對袋子1測試所展示的那樣。所有經(jīng)過測試的器械都通過了USP< 788 >中大容量注射劑的限量要求,。
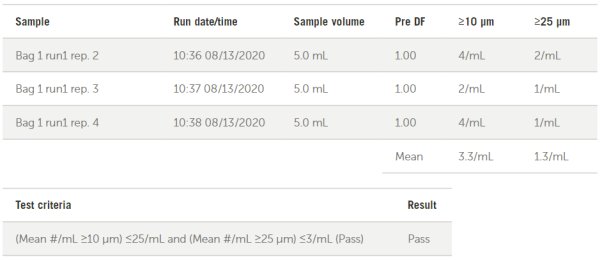
圖12. 袋子1 USP<788>大容量注射劑報告
3.1 結(jié)論
眾多標(biāo)準(zhǔn),、美國藥典(USP)測試以及美國食品藥品監(jiān)督管理局(FDA)的指導(dǎo)文件都為醫(yī)療器械中的微粒污染提供了測試方法和驗收標(biāo)準(zhǔn)。但終端用戶往往需要對這些文件進行解讀,,將相關(guān)原則應(yīng)用到他們特定的器械上,,并限定可接受的微粒數(shù)量。使用英特格(Entegris)公司的AccuSizer SIS液體微粒計數(shù)器可實現(xiàn)微粒尺寸和計數(shù)及報告的自動化,,這通常使得分析測量成為整個流程中較容易的部分,。

相關(guān)產(chǎn)品
更多
相關(guān)文章
更多
技術(shù)文章
2025-04-18技術(shù)文章
2025-04-18技術(shù)文章
2025-03-05技術(shù)文章
2025-02-26
虛擬號將在 秒后失效
使用微信掃碼撥號