
北京精微高博儀器有限公司
 白金會員
白金會員 已認證
已認證

北京精微高博儀器有限公司
 白金會員
白金會員 已認證
已認證
原理闡述
SSITKA 實驗裝置
SSITKA實驗裝置示意圖如下圖1所示,,包含氣路控制部分、反應(yīng)器和質(zhì)譜分析三部分[1],。氣路控制部分要適合于穩(wěn)態(tài)瞬變操作,保證迅速切換且前后狀態(tài)處于穩(wěn)定狀態(tài),,同時質(zhì)譜可以迅速響應(yīng),。

圖1 SSITKA的實驗裝置示意圖
當前大部分SSITKA實驗是通過在微反上進行搭建而成,屬于手動或者半自動裝置,,會帶來手動誤差,。北京精微高博儀器有限公司的AMI 300TKA儀器通過特殊氣路設(shè)置并配置質(zhì)譜檢測儀完成SSITKA實驗,如下圖2所示 AMI 300TKA軟件界面圖,,氣路控制部分由四通閥完成瞬變切換,,Aux Gases和Blend Gases兩種進料流分別通入未標記反應(yīng)物12CO和同位素標記反應(yīng)物13CO,四通閥切換后,,反應(yīng)物可由12CO轉(zhuǎn)換為其同位素標記物13CO,。
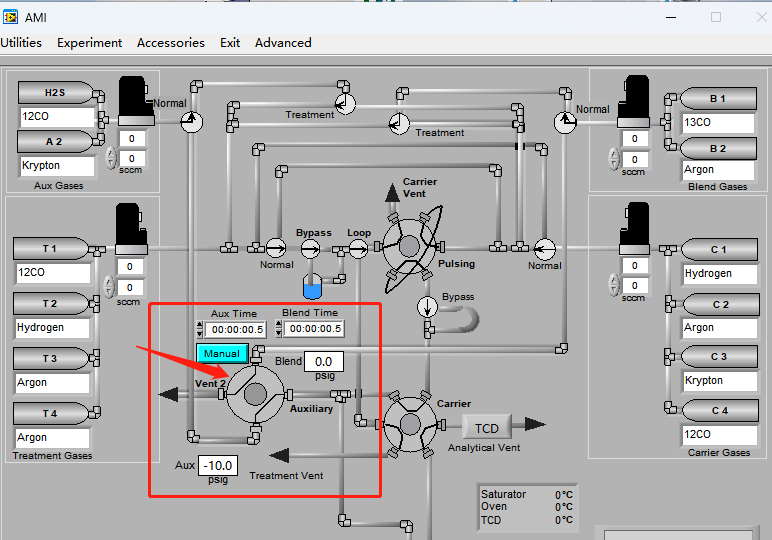
圖2 AMI300TKA軟件界面
SSITKA實驗可通過下圖3所示程序進行設(shè)置,完全自動,,無需手動操作,,方便可行,消除人為操作誤差,,保證測試結(jié)果的精確性,。
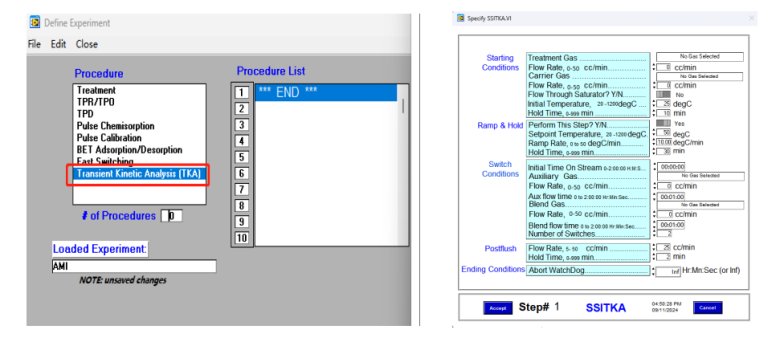
圖3 AMI300TKA儀器SSITKA程序設(shè)置
SSITKA 動力學(xué)參數(shù)求解
一般參數(shù)求解
表面中間物種的表面停留時間 τP 和表面中間物種的量 NP
通過質(zhì)譜檢測到強度如下圖4(a)所示,P為未標記產(chǎn)物,,P*為其同位素標記產(chǎn)物,,I是惰性示蹤劑,t=0時刻四通閥切換,,反應(yīng)物轉(zhuǎn)換為同位素標記物,,產(chǎn)物P和惰性示蹤劑I呈現(xiàn)衰減而同位素產(chǎn)物P*呈現(xiàn)遞增響應(yīng),將產(chǎn)物P的衰減響應(yīng)進行歸一化處理得到瞬變響應(yīng)曲線見下圖4(b),。
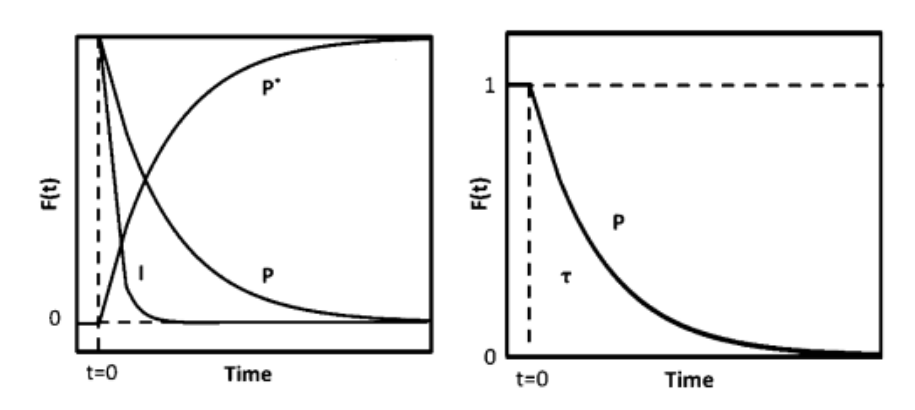
圖4 (a)質(zhì)譜圖 (b)瞬變響應(yīng)曲
不進行動力學(xué)假設(shè),、不建立表面機理模型,通過瞬變響應(yīng)曲線可求取兩個參數(shù),,生成產(chǎn)物P的中間物種表面停留時間(表面壽命) τP 和表面中間物種的量 NP ,,NP 公式如下[2]:
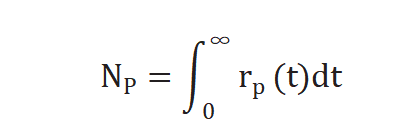
實驗過程中對反應(yīng)物進行快速切換,反應(yīng)速率不變,,未標記產(chǎn)物反應(yīng)速率通過下列公式求得[3],,r p(t)是未標記產(chǎn)物穩(wěn)態(tài)反應(yīng)速率,,r p*(t) 和同位素標記產(chǎn)物的反應(yīng)速率。
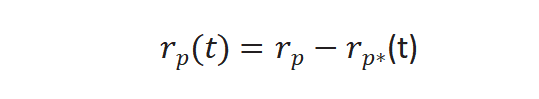
圖4(b)所示未標記產(chǎn)物衰減歸一化得到瞬變響應(yīng)曲線,,F(xiàn)P(t)公式如下:
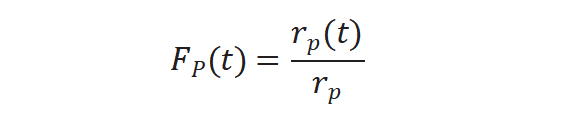
將上述三個公式重新排序計算得到中間物種的表面停留時間τP :
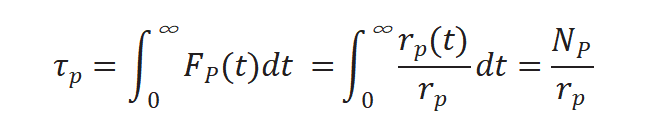
對瞬變響應(yīng)曲線積分得出表面停留時間 τP,,如圖5所示。
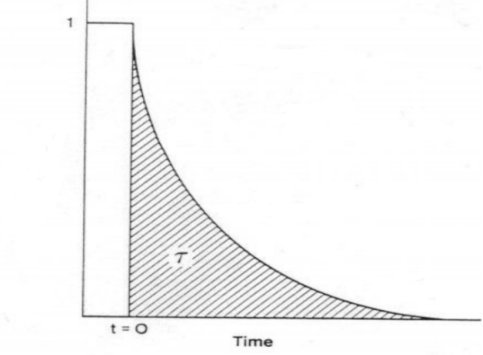
圖5 表面停留時間 τP
表面中間物種覆蓋度θ,、反應(yīng)速率常數(shù)K和周轉(zhuǎn)頻率TOF
采用化學(xué)吸附的方法測試出催化劑表面暴露的金屬原子總數(shù)NC,,通過表面中間物種的量NP計算出中間物種的表面覆蓋度θ,公式如下:
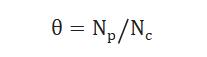
假設(shè)表面進行的化學(xué)反應(yīng)為擬一級,,擬一級反應(yīng)的速率方程可表示為:
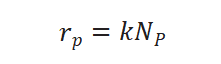
從而求得擬一級反應(yīng)速率常數(shù):
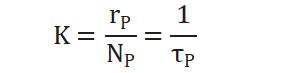
TOF周轉(zhuǎn)頻率表示單位時間內(nèi),,單位活性位上發(fā)生催化反應(yīng)的次數(shù),這是基于表面活性位點數(shù)量的速率,,是催化劑瞬時效率的量度,,公式如下:
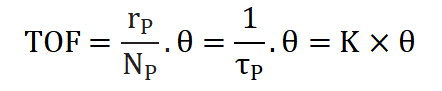
這里的為中間物種的表面覆蓋率,通過反卷積技術(shù)可確定催化劑表面活性位點的數(shù)量和分布情況,,可進一步研究催化反應(yīng)動力學(xué)及其機理,。
SSITKA 建模
一個非均相化學(xué)反應(yīng)可能經(jīng)歷一個或多個催化劑表面中間步驟才能完成,而前面所求的一般參數(shù)表面中間物種的停留時間τP 和表面中間物種的量 NP 是生成產(chǎn)物 P 表面中間物種的總停留時間和表面中間物種的總量,。為得到生成產(chǎn)物 P 的各中間物種的量及其壽命,,Shannon [4]和 Chen [5]等在 Biloen[6]等工作的基礎(chǔ)上,提出了下表1非均相反應(yīng)催化劑表面機理模型,,首先將反應(yīng)分成可逆和不可逆兩種情況,,然后再進一步分成單一反應(yīng)中間物種、串聯(lián)反應(yīng)中間物種,、平行反應(yīng)中間物種等幾種情況,,然后根據(jù)物料衡算,推導(dǎo)出瞬變響應(yīng)模型,,由瞬變響應(yīng)模型求取各反應(yīng)中間物種的量及其停留時間等動力學(xué)參數(shù),。

表1 由SSITKA獲得的機理模型、瞬態(tài)響應(yīng)和動力學(xué)參數(shù)
推斷催化劑表面反應(yīng)機理
Kobayashi [8]等通過實驗發(fā)現(xiàn)通過分析響應(yīng)曲線的形狀,,可以推斷出反應(yīng)機理,。Shannon 等給出了單一反應(yīng)中間物種、兩個串聯(lián)反應(yīng)中間物種和兩個平行反應(yīng)中間物種的不可逆反應(yīng)瞬間響應(yīng)( 圖6) ,。
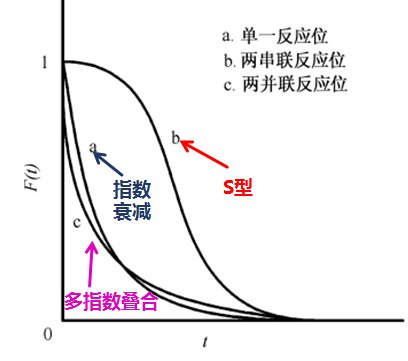
圖6 不同表面反應(yīng)機理的瞬變響應(yīng)示意圖
從上述圖6中,,瞬變響應(yīng)曲線顯示為 S 形,衰減最慢的曲線b為兩串聯(lián)反應(yīng)位,,這是由于兩串聯(lián)位順序進行反應(yīng),,用時較長;單指數(shù)衰減的瞬變響應(yīng)曲線a為單一反應(yīng)位,;多指數(shù)衰減的瞬變響應(yīng)曲線c為兩并聯(lián)反應(yīng)位,,這是因為并聯(lián)反應(yīng)位在各路徑下平行反應(yīng),,其衰減速率快呈現(xiàn)多指數(shù)疊合狀。觀察瞬變響應(yīng)曲線可非常容易看出不同動力學(xué)模型的差異,,從而推斷出催化劑表面反應(yīng)的差別,。
SSITKA 實驗中的影響因素
色譜效應(yīng)和再吸附
反應(yīng)物和產(chǎn)物不僅可以吸附在催化劑表面,也有可能吸附在反應(yīng)器的管路和壁上而產(chǎn)生色譜效應(yīng),,可通過縮短由四通閥到檢測器的管路和反應(yīng)器的長度,,提高氣體的流速,對管路采取保溫措施來減小產(chǎn)生色譜效應(yīng)的影響,。AMI-300TKA采用1/16的管路減小死體積,,對閥箱進行保溫,MFC精確控制氣體流速等措施提高測試精度,。
SSITKA實驗中產(chǎn)物的再吸附效應(yīng)會對瞬變響應(yīng)產(chǎn)生影響,,若產(chǎn)物再吸附發(fā)生在活性位導(dǎo)致活性和反應(yīng)速率下降,,若產(chǎn)物再吸附發(fā)生在非反應(yīng)活性位,,雖活性不受影響,但測量的生成產(chǎn)物表面停留時間包括產(chǎn)物中間體真實停留時間和再吸附的停留時間,。
上述情況一般采用加入惰性示蹤劑和經(jīng)驗公式進行校正,,修正公式如下:
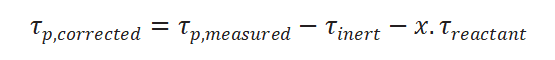
為惰性氣體響應(yīng)時的表面停留時間,此處x根據(jù)經(jīng)驗一般取0.5,。
同位素效應(yīng)
SSITKA 實驗中假定反應(yīng)處于穩(wěn)態(tài)條件,,忽略同位素效應(yīng),即假定同位素物種在動力學(xué)行為上沒有差別,,此時需特別注意氫及其同位素的使用,,因為氫同位素間的質(zhì)量和鍵能差別相對較大,由此會引起動力學(xué)和熱力學(xué)上的差別,。氫/氘(H/D)同位素交換時,,動力學(xué)速率和表面中間物種可能產(chǎn)生較大變化,系統(tǒng)無法保持穩(wěn)定狀,,因此采用H同位素實驗時需注意,。H/D同位素進行SSITKA實驗可提供有關(guān)活性表面特征的信息,如H/D同位素交換實驗?zāi)荑b別隨著吸附,、脫附或反應(yīng)的進行,,某一特定分子物種鍵的斷裂。
SSITKA 與光譜的聯(lián)用
SSITKA技術(shù)可以識別中間體的豐度及其動力學(xué)參數(shù),,其局限性是不能直接表征表面反應(yīng)中間物的結(jié)構(gòu)和直接監(jiān)測其表面反應(yīng),,而原位紅外技術(shù)允許直接觀察反應(yīng)條件下的吸附物種[9]。將SSITK與FTIR有機地結(jié)合起來,,可正確表征表面中間物種,,包括其化學(xué)結(jié)構(gòu)和表面覆蓋度,,并可分辨吸附反應(yīng)物種和非反應(yīng)物種[10]。下圖7所示為北京精微高博儀器有限公司AMI-300TKA原位紅外表征儀器,,可以做原位表征,。

圖7 AMI-300TKA 原位表征
自20世紀70年代發(fā)明此項技術(shù)后它已經(jīng)用于研究工業(yè)上許多不同和重要的化學(xué)反應(yīng)機理。現(xiàn)今隨著SSITKA與光譜技術(shù)的結(jié)合,,可監(jiān)測真實的表面中間體和反應(yīng)機制,。此外,SSITKA還可與其他方法如動力學(xué)建模,、DFT等結(jié)合時,,可以獲得更多關(guān)于反應(yīng)途徑的信息。結(jié)合SSITKA和其他技術(shù)優(yōu)勢,,在反應(yīng)條件下獲取盡可能多的信息,,以闡明具有復(fù)雜化學(xué)反應(yīng)的機理。
參考文獻
[1]李春義 沈師孔 穩(wěn)態(tài)同位素瞬變動力學(xué)分析 [J] 化學(xué)進展,,1999,11(2):49-59.
[2]Recent Approaches in Mechanistic and Kinetic Studies of Catalytic, Cristian Ledesma,Jia Yang,De Chen, and Anders Holmen,,ACS Catal. 2014, 4, 4527?4547
[3]Anders Holmen, Jia Yang, and De Chen Springer Handbook of Advanced Catalyst Characterization, Springer Handbooks,Part VII Transient and Thermal Methods,2023,41,935-966.
[4]Shannon, S. L.; Goodwin, J. G. Chem. Rev. 1995, 95, 677?695.
[5] Berger, R. J.; Kapteijn, F.; Moulijn, J. A.; Marin, G. B.; De Wilde,J.; Olea, M.; Chen, D.; Holmen, A.; Lietti, L.; Tronconi, E.;Schuurman, Y. Appl. Catal., A 2008, 342, 3?28.
[6]Kondratenko, E. V. Catal. Today 2010, 157, 16?23.
[7] Pansare, S.; Sirijaruphan, A.; Goodwin, J. G. In Isotopes in Heterogeneous Catalysis; Hutchings, G. J., Ed.; World Scientific Publishing Co.: London, 2006; Catalytic Science Series, Vol. 4, pp 183?206.[8]Kobayashi H,Kobayashi M ,,Catal.Rev.-Sci.Eng.,,1974,10,,139.
[9]Yokomizo G H,,Bell A T ,J .Catal.,,1989,,119,467—482.
[10] Efstathiou A M ,,Chafik T ,,Bianchi D et al.,J .Catal.,,1994,,148,224—239.
相關(guān)產(chǎn)品
更多
相關(guān)文章
更多
技術(shù)文章
2025-05-09技術(shù)文章
2025-03-01技術(shù)文章
2025-03-01技術(shù)文章
2025-02-15
虛擬號將在 秒后失效
使用微信掃碼撥號