
北京精微高博儀器有限公司
 白金會員
白金會員 已認(rèn)證
已認(rèn)證

北京精微高博儀器有限公司
 白金會員
白金會員 已認(rèn)證
已認(rèn)證
背景介紹
催化劑是現(xiàn)代化學(xué)工業(yè)的“心臟”,,50%以上的化工產(chǎn)品與催化劑有關(guān),,為提高催化劑的性能,需研究催化劑與反應(yīng)物界面上物理化學(xué)過程如擴散,、吸/脫附,、反應(yīng)或表面重構(gòu),這些研究涉及到催化劑表面發(fā)生化學(xué)反應(yīng)的機理和反應(yīng)速率等動力學(xué)參數(shù),,SSITKA技術(shù)是由Happel,、Bennet 和Biloen于20世紀(jì)70年代開發(fā),,這項技術(shù)可以在穩(wěn)定狀態(tài)下檢測動力學(xué)參數(shù),,保持化學(xué)反應(yīng)穩(wěn)態(tài)信息不受干擾情況下,通過同位素瞬態(tài)切換獲得催化劑表面中間物種濃度,、位點覆蓋率和速率常數(shù)等定量反應(yīng)數(shù)據(jù),,進而推測化學(xué)反應(yīng)機理,對設(shè)計高性能催化劑具有重要的理論和實際意義,。
SSITKA定義
SSITKA:Steady State Isotopic Transient Kinetic Analysis,,穩(wěn)態(tài)同位素瞬變動力學(xué)分析技術(shù),,在穩(wěn)態(tài)條件下快速將反應(yīng)物切換為對應(yīng)同位素,質(zhì)譜檢測未標(biāo)記的反應(yīng)物和產(chǎn)物不斷減少而同位素標(biāo)記的反應(yīng)物和產(chǎn)物不斷增加的曲線(瞬變響應(yīng)曲線),,被用于研究多相催化反應(yīng)機理和動力學(xué),。在這里穩(wěn)態(tài)是指在切換過程中反應(yīng)體系的流率、壓力,、溫度,、催化劑表面狀態(tài)以及反應(yīng)物和產(chǎn)物的濃度都不發(fā)生變化,并且同位素效應(yīng)可以忽略[2],;工業(yè)過程大都是在穩(wěn)態(tài)條件下運行,,化學(xué)過程中所涉及的參數(shù)如溫度、壓力,、濃度和流量都不隨時間變化,,可以有效地確定催化性能、化學(xué)反應(yīng)的順序和活化能,。同位素標(biāo)記法最初由于使用放射性同位素而受限,,隨著研究的進展,高純度13C,、18O,、15N、D等各種穩(wěn)定同位素商品化,,同位素及其化合物標(biāo)記法被用來研究化學(xué)反應(yīng)動力學(xué)和機理的研究,。瞬變是指在反應(yīng)物及其同位素標(biāo)記物間的理想快速切換,瞬變通過一個四通閥來實現(xiàn),,可以在兩種進料流間進行切換,,一種進料中存在未標(biāo)記的反應(yīng)物,另一種進料中為對應(yīng)的標(biāo)記的同位素反應(yīng)物,,由反應(yīng)物切換到其同位素標(biāo)記物后,,通過質(zhì)譜檢測到瞬變響應(yīng)曲線,從而推測反應(yīng)機理,,進行動力學(xué)分析并計算其參數(shù),,得到催化劑表面反應(yīng)的信息。
SSITKA在催化劑中的應(yīng)用
SSITKA 被用于催化體系的研究,,最直接的動力學(xué)參數(shù)是平均停留時間,、表面中間體的量以及本征動力學(xué)速率常數(shù),這些參數(shù)可用來計算活性位點的數(shù)量及分布,,確定表面催化反應(yīng)的途徑,,從而可以闡述催化反應(yīng)機理,包括載體、促進劑,、合金和失活的影響機制,。
SSITKA在催化機理的應(yīng)用
乙烯是重要的有機化工原料,在PdCl和CuCl的催化下生成乙醛,,在銀催化劑下生成EO(環(huán)氧乙烷),,由于原位表征的缺乏和活性位點認(rèn)識不清,單原子氧Agx-O和雙原子氧Ag-O-O-Ag均被提出為選擇性氧化位點,,L-H, E-R和MvK機理均有被提出,,理海大學(xué)化學(xué)與生物分子工程學(xué)院Israel E Wachs教授團隊?wèi)?yīng)用原位拉曼和SSITKA聯(lián)用技術(shù),揭示了負(fù)載型Ag/α-Al2O3 催化劑乙烯氧化的活性位點和催化機理,。
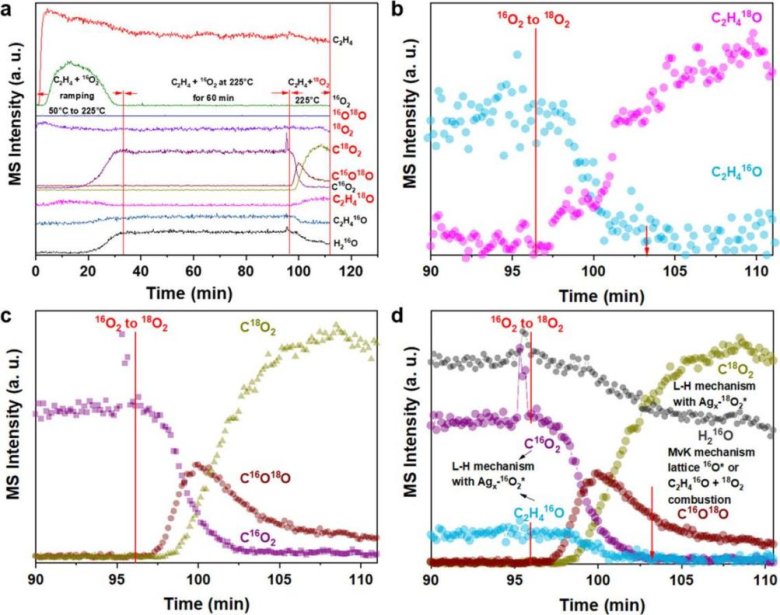
圖1 C2= + 16O2 → 18O2 SSITKA實驗
圖1用AMI-200進行SSITKA 實驗采集的質(zhì)譜圖,,圖1b, c所示,在C2= +16O2→18O2切換后,,EO(環(huán)氧乙烷)和CO2產(chǎn)物迅速下降并在7分鐘左右歸零,,這證明乙烯環(huán)氧化和完全氧化通過L-H機理進行,即需要吸附態(tài)的乙烯和Ag4-O2物種反應(yīng),。切換為18O2后,,產(chǎn)物C2H416O和C16O2逐步降低且信號逐漸趨零,C16O18O的信號卻逐漸抬升,,這說明在反應(yīng)副產(chǎn)物CO2的生成中有顯著的MvK(晶格氧物種)機理參與,。SSITKA實驗證明銀催化乙烯環(huán)氧化主要以L-H機理,完全氧化則同時有L-H和MvK機理進行,。
SSITKA 在F-T合成中的應(yīng)用
合成氣 (CO + H2) 經(jīng)費托合成轉(zhuǎn)化為清潔燃料與化學(xué)品是煤炭清潔利用的重要途徑,,該過程產(chǎn)物復(fù)雜、選擇性低限制了發(fā)展,。近年來通過設(shè)計高效的催化劑以獲得更好的性能,,由于失活速度慢和碳鏈增長率相對較高,鈷基催化劑被用來生產(chǎn)高質(zhì)量柴油燃料,。添加助劑也可顯著改變催化劑性能,,目前研究助劑在反應(yīng)中動力學(xué)的影響較少。挪威科技大學(xué)楊佳教授團隊與青島大學(xué)楊曉麗課題組[4]以Rh,、Ir,、Sb和Ga對Co基催化劑進行改性,研究其在費托合成中的影響,,采用SSITKA技術(shù)進一步研究了其內(nèi)在活性和表面吸附性能,。
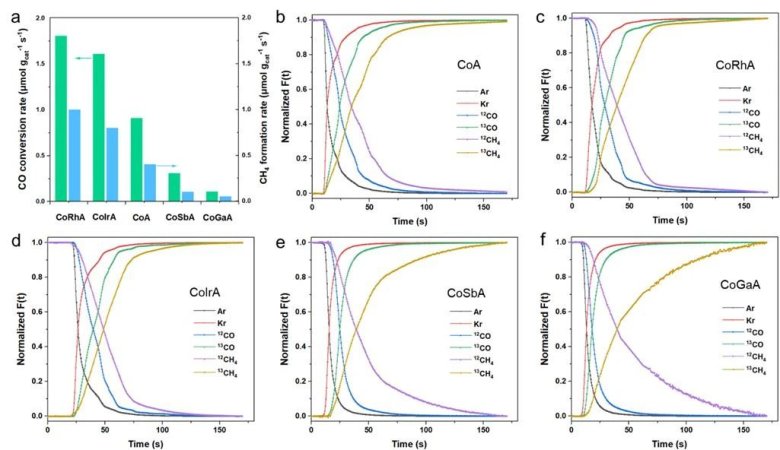
圖2 (a) SSITKA條件下CoM/Al2O3催化劑上CO轉(zhuǎn)化率和CH4生成速率。(b) CoA,,(c) CoRhA,,(d) CoIrA,(e) CoSbA和(f) CoGaA的歸一化瞬態(tài)曲線
SSITKA實驗反應(yīng)氣體由12CO/H2/Ar 轉(zhuǎn)換為13CO/H2/Ar,,其歸一化瞬變曲線見上述圖2,,對瞬變曲線進行參數(shù)計算得到下表1所示:
表1 Co基催化劑SSITKA參數(shù)
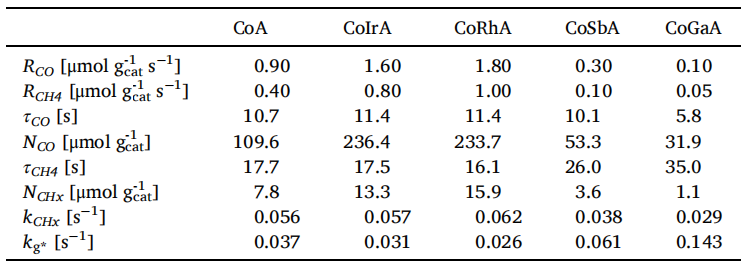
通過穩(wěn)態(tài)SSITKA參數(shù)分析發(fā)現(xiàn):CoRh/Al2O3和CoIr/Al2O3催化劑的反應(yīng)物NCO表面中間體的量分別為(236和234μmol gcat-1),相比CoA(109.6μmol gcat-1)提高了2倍,,而CoSb/Al2O3和CoGa/Al2O3催化劑降低分別為53和39μmol gcat-1,,,這些數(shù)據(jù)表明說明貴金屬Ir和Rh對催化劑有促進作用,,增加了更多的活性位點,,從而可以吸附更多的CO,產(chǎn)物NCHx 表面中間體的量具有相同的趨勢,,而非貴金屬Sb和Ga助劑呈現(xiàn)相反的趨勢,。同時對停留時間進行了分析,發(fā)現(xiàn)這四種助劑的停留時間差異不大,,貴金屬對催化劑的內(nèi)在活性沒有明顯影響,,而非貴金屬減少活性位點和內(nèi)在活性位點。
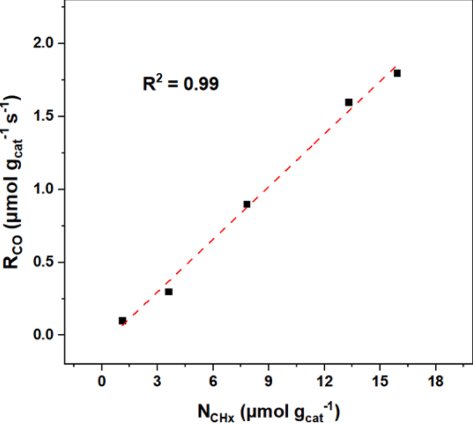
圖3 CoM/Al2O3的CO反應(yīng)速率與CO和CHx中間體濃度的關(guān)系圖
圖3對CO反應(yīng)速率和表面濃度以及本征速率常數(shù)進行了對比,,CO的反應(yīng)速率與Nco濃度無關(guān),,說明CO轉(zhuǎn)化率與CO和H2兩方面的覆蓋率有關(guān),與NCHx 線性相關(guān),,表明CHx濃度改變CO反應(yīng)速率,,圖10所示為碳鏈生成反應(yīng)途徑,通過公式計算催化劑上的碳鏈增長能力,,發(fā)現(xiàn)Ir和Rh的添加會抑制碳鏈增長,,而Sb和Ga則會促進碳鏈增長。換言之,,助劑會影響反應(yīng)過程表面CHx濃度而改變CO反應(yīng)速率,,影響碳鏈增長速率常數(shù)而改變產(chǎn)物分布,進一步分析其主要原因是助劑引起了活性金屬的不同電子性能導(dǎo)致較低的吸附強度,。
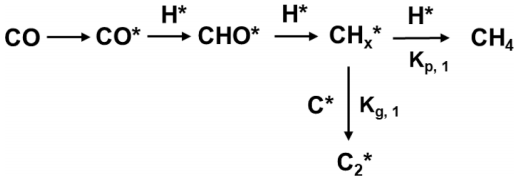
圖4 CHx中間體生成CH4和C2 +的反應(yīng)途徑
該文章通過動力學(xué)方面研究了助劑對Co基催化劑在費托合成中的影響,,并且揭示了基于動力學(xué)因素的FTS反應(yīng)性能優(yōu)異的根本原因,為優(yōu)化催化劑奠定了基礎(chǔ),。
穩(wěn)態(tài)同位素瞬態(tài)動力學(xué)分析(SSITKA)是一種確定表面中間體數(shù)量和性質(zhì)以及催化過程動力學(xué)參數(shù)的技術(shù)?,F(xiàn)今隨著科學(xué)技術(shù)的發(fā)展,SSITKA還可與其他方法如光譜,、動力學(xué)建模,、DFT結(jié)合,在反應(yīng)條件下獲取盡可能多的信息,,其原理及詳細信息將在下篇文章進行詳細介紹,。
參考文獻
[1]Recent Approaches in Mechanistic and Kinetic Studies of Catalytic, Cristian Ledesma,Jia Yang,De Chen, and Anders Holmen,,ACS Catal. 2014, 4, 4527?4547
[2]李春義 沈師孔 穩(wěn)態(tài)同位素瞬變動力學(xué)分析 [J] 化學(xué)進展,1999,11(2):49-59.
[3]Tiancheng Pu, Adhika Setiawan, Revealing the Nature of Active Oxygen Species and Reaction
Mechanism of Ethylene Epoxidation by Supported Ag/-Al2O3 Catalysts: ACS Catal. 2024, 14, 406?417.
[4]Xiaoli Yang, Jia Yang, Anders Holmen, Kinetic insights into the effect of promoters on Co/Al2O3 for Fischer-Tropsch synthesis,Chemical Engineering Journal 445 (2022) 136655. [11]Yokomizo G H,,Bell A T ,,J .Catal.,1989,,119,,467—482.
相關(guān)產(chǎn)品
更多
相關(guān)文章
更多
技術(shù)文章
2025-05-09技術(shù)文章
2025-03-01技術(shù)文章
2025-03-01技術(shù)文章
2025-02-15
虛擬號將在 秒后失效
使用微信掃碼撥號