
北京海岸鴻蒙標(biāo)準(zhǔn)物質(zhì)技術(shù)有限責(zé)任公司
 白金會(huì)員
白金會(huì)員 已認(rèn)證
已認(rèn)證

北京海岸鴻蒙標(biāo)準(zhǔn)物質(zhì)技術(shù)有限責(zé)任公司
 白金會(huì)員
白金會(huì)員 已認(rèn)證
已認(rèn)證

(以下數(shù)據(jù)由鴻蒙標(biāo)準(zhǔn)物質(zhì)小編進(jìn)行不完全統(tǒng)計(jì))
近年來(lái),,國(guó)內(nèi)外藥企因可見(jiàn)異物被召回,、罰沒(méi)的事件頻發(fā),。
據(jù)不完全統(tǒng)計(jì),,2020年至今,在中國(guó)因藥品質(zhì)量問(wèn)題召回的產(chǎn)品,,注射劑產(chǎn)品不在少數(shù),,其中召回原因中“可見(jiàn)異物”不符合規(guī)定出現(xiàn)的頻次頗多,并有企業(yè)在近幾年多次因可見(jiàn)異物多次被罰,,其中某企業(yè)被罰金額高達(dá)650萬(wàn),。
根據(jù)我國(guó)《中華人民共和國(guó)藥品管理法》第一百一十七條規(guī)定:生產(chǎn)、銷售劣藥的,,沒(méi)收違法生產(chǎn),、銷售的藥品和違法所得,并處違法生產(chǎn),、銷售的藥品貨值金額十倍以上二十倍以下的罰款,;違法生產(chǎn)、批發(fā)的藥品貨值金額不足十萬(wàn)元的,,按十萬(wàn)元計(jì)算,,違法零售的藥品貨值金額不足一萬(wàn)元的,按一萬(wàn)元計(jì)算,;情節(jié)嚴(yán)重的,,責(zé)令停產(chǎn)停業(yè)整頓直至吊銷藥品批準(zhǔn)證明文件,、藥品生產(chǎn)許可證、藥品經(jīng)營(yíng)許可證或者醫(yī)療機(jī)構(gòu)制劑許可證,。
藥品面前無(wú)小事,,可見(jiàn)異物問(wèn)題不容小覷。不僅國(guó)內(nèi)嚴(yán)格,,國(guó)外亦是如此,!
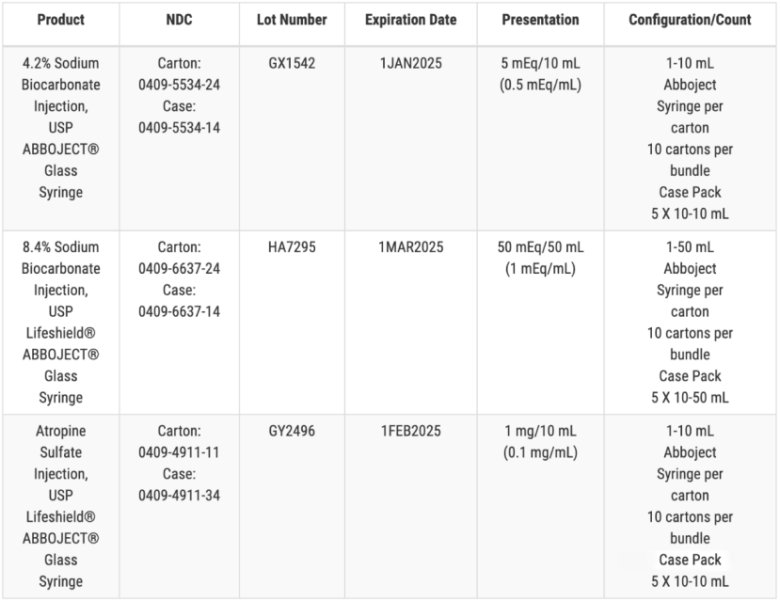
2023年12 月 21日,輝瑞旗下無(wú)菌注射劑部門 Hospira 宣布了兩次獨(dú)立的召回,,原因是某些藥物的小瓶和注射器中可能存在玻璃顆粒,。Hsopira一年發(fā)生過(guò)多次召回事件,卻并沒(méi)有更進(jìn)一步解決玻璃顆粒污染問(wèn)題,。
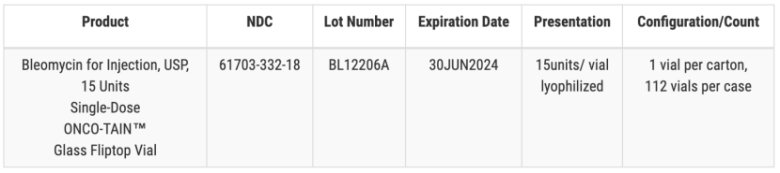
這不是 Hospira 的第一次召回事件,,早在2017 年和 2018 年,Hospira 就因一批 25% 嬰兒葡萄糖注射液的注射器中發(fā)現(xiàn)顆粒,、微生物生長(zhǎng)和人類毛發(fā)問(wèn)題而多次召回注射液,。而2023年 12 月底,Hospira 召回了一批 1.5g 劑量的抗生素鹽酸萬(wàn)古霉素,,原因是小瓶中有玻璃顆粒,。10 月份,召回了一批有效期為 2024 年 8 月的 4.2% 的碳酸氫鈉注射劑,,同樣是玻璃顆粒問(wèn)題,。Hospira 還召回了一批有效期為 2024 年 6 月的 1% 鹽酸利多卡因注射劑和一批有效期為 2024 年 7 月的 2% 鹽酸利多卡因注射劑。
藥品中的可見(jiàn)異物問(wèn)題會(huì)影響企業(yè)的品牌形象,,降低消費(fèi)者對(duì)企業(yè)的信任度,,從而影響企業(yè)的銷售和市場(chǎng)占有率。因此,,藥品生產(chǎn)企業(yè)需要采取有效措施控制可見(jiàn)異物的產(chǎn)生,,確保產(chǎn)品質(zhì)量符合要求,以避免對(duì)企業(yè)造成不良影響,。
《中國(guó)藥典2020版:0904可見(jiàn)異物檢查法》中規(guī)定:可見(jiàn)異物系指存在于注射劑,、眼用液體制劑和無(wú)菌原料藥中,在規(guī)定條件下目視可以觀測(cè)到的不溶性物質(zhì),,其粒徑或長(zhǎng)度通常大于50μm,。采用燈檢法進(jìn)行結(jié)果判定時(shí),供試品中不得檢出塊狀物,、金屬屑,、玻璃屑、纖維,、絮狀物,、點(diǎn)狀物等明顯的可見(jiàn)異物,。
注射劑、眼用液體制劑應(yīng)在符合藥品生產(chǎn)質(zhì)量管理規(guī)范(GMP)的條件下生產(chǎn),,產(chǎn)品在出廠前應(yīng)采用適宜的方法逐一檢查并同時(shí)剔除不合格產(chǎn)品,。臨用前,需在自然光下目視檢查(避免陽(yáng)光直射),,如有可見(jiàn)異物,,不得使用。
為什么注射液中會(huì)有可見(jiàn)異物存在呢?因?yàn)樵谧⑸湟旱纳a(chǎn),、儲(chǔ)存,、運(yùn)輸、配置和使用過(guò)程中幾乎都有可能被可見(jiàn)異物/不溶性微粒污染,。通過(guò)應(yīng)用可見(jiàn)異物標(biāo)準(zhǔn)物質(zhì),,可以加強(qiáng)藥品的檢測(cè)力度,同時(shí)還可為企業(yè)建立產(chǎn)品追溯體系,,便于確定異物的最初來(lái)源及材質(zhì),,保障后續(xù)產(chǎn)品生產(chǎn)。
海岸鴻蒙作為全國(guó)唯一一家獲得可見(jiàn)異物標(biāo)準(zhǔn)物質(zhì)證書(shū)的企業(yè),,我們能夠?yàn)橹扑幮袠I(yè)提供更加精準(zhǔn),、可靠的檢測(cè)服務(wù)、可見(jiàn)異物溯源及專屬可見(jiàn)異物解決方案,,所生產(chǎn)的可見(jiàn)異物微粒標(biāo)準(zhǔn)物質(zhì)完全符合《中國(guó)藥典2020版:0904可見(jiàn)異物檢查法》要求,,可幫助企業(yè)深入分析可見(jiàn)異物來(lái)源、檢測(cè)設(shè)備檢定校準(zhǔn)與相關(guān)人員培訓(xùn),,為我國(guó)醫(yī)藥行業(yè)可見(jiàn)異物的質(zhì)量控制提供幫助,,并協(xié)助建立整體的、全生命周期管理的可見(jiàn)異物控制策略,,保障企業(yè)經(jīng)營(yíng)。


全國(guó)唯一一張可見(jiàn)異物證書(shū)
海岸鴻蒙作為深耕二十七載的標(biāo)準(zhǔn)物質(zhì)研發(fā)生產(chǎn)企業(yè),,顆粒標(biāo)準(zhǔn)物質(zhì)的研發(fā)已經(jīng)達(dá)到國(guó)內(nèi)領(lǐng)先,、國(guó)際先進(jìn)水平,可見(jiàn)異物等百余種標(biāo)準(zhǔn)物質(zhì)的研制成功填補(bǔ)國(guó)內(nèi)空白,,并可提供特殊定制服務(wù),,幫助藥企減少風(fēng)險(xiǎn),保障患者安全,。
最新動(dòng)態(tài)
更多



虛擬號(hào)將在 秒后失效
使用微信掃碼撥號(hào)