
上海奧法美嘉生物科技有限公司
 鉆石會員
鉆石會員 已認證
已認證

上海奧法美嘉生物科技有限公司
 鉆石會員
鉆石會員 已認證
已認證
摘要:
目的:不溶性微粒是臨床輸液安全性評估的重要指標,。本研究旨在評價抗生素不同包裝對小粒徑范圍(<10 μm)不溶性微粒分布的影響,,為解釋臨床不良反應和指導合理用藥提供依據(jù)。
方法:采用常規(guī)光阻法和單顆粒光學傳感(SPOS)技術測定不同廠家不同包裝(雙腔袋和小瓶)復溶注射液中不溶性微粒的粒徑分布,。為了驗證我們的假設,,控制原料藥(API)和溶劑一致,避免兩者對結果的影響。此外,,利用掃描電子顯微鏡(SEM)觀察不同包裝注射劑的不溶性微粒的形態(tài)特征,。
結果:復溶后,雙腔袋包裝的粉針劑溶液中小粒徑不溶性微粒(<10 μm)明顯低于西林瓶包裝的常規(guī)粉針劑,。SEM觀察到的結果也證明了兩種包裝形式之間不溶性微粒的數(shù)量差異,,顯示出裝在瓶中的氯化鈉溶解制劑中的不溶性微粒數(shù)量較多,且形狀不規(guī)則,。
結論:在我們的研究中,,不溶性微粒分布的差異主要歸因于包裝形式。雙腔袋注射可能是減少不溶性微粒引起的不良反應的有效替代方案,。
《臨床使用靜脈輸液基本評價指南》提出的18項評價指標中,,不溶性微粒是臨床輸液安全性評價中最重要的指標之一。2020年版《中國藥典》(ChP 2020),,僅對注射劑中粒徑大于10 μm的亞可見顆粒設定了限定,,并沒有對較小顆粒提出具體要求。但人體最細的毛細血管直徑為 4-7 μm,,>8 μm 的顆??赡軙焕г诜尾浚?<8 μm 的顆??赡軙练e在肝臟、脾臟和骨髓中,。因此,,小粒徑(<10 μm)不溶性微粒。
Walpot等人在研究中觀察到的大多數(shù)微血栓與直徑小于2 μm的顆粒(玻璃,、乳膠和聚合物)有關,,這些顆粒污染物構成了靜脈液體中的大部分顆粒污染物。此外,,動物模型也展示了小粒徑不溶性微粒物的不利影響,。Stehbens和Florey將直徑在0.2-0.5μm之間的顆粒靜脈注射到兔子體內,發(fā)現(xiàn)了與血小板和中性粒細胞相關的閉塞性微血栓,。
復旦大學沙先誼老師采用常規(guī)光阻法和單顆粒光學傳感(SPOS)技術測定不同廠家不同包裝(雙腔袋和小瓶)復溶注射液中不溶性微粒的粒徑分布,。旨在評價抗生素不同包裝對小粒徑范圍(<10 μm)不溶性微粒分布的影響,為解釋臨床不良反應和指導合理用藥提供依據(jù),。
1 實驗材料
A制劑:注射用頭孢唑林鈉/氯化鈉注射液(雙腔袋包裝,,1.0g/100mL;蘇州大冢制藥有限公司,,中國蘇州),;
B制劑:注射用頭孢唑林鈉(小瓶包裝,每瓶0.5g,,廠家1),;
C制劑:注射用頭孢唑林鈉(小瓶包裝,,每瓶0.5g,廠家2),;
2 實驗方法
1. 制備方法
雙腔袋包裝注射液不溶性微粒樣品制備方法:
按照藥品說明書溶出操作方法,,將兩室內容物混合,確認粉劑完全溶解至獲得臨床藥物溶液,。
小瓶包裝注射液不溶性微粒樣品制備方法:
用 10 mL 無菌注射器(KDL 一次性無菌注射器,,浙江康德萊醫(yī)療器械有限公司,中國杭州)將 5 mL 氯化鈉注射液注入搖勻溶解1分鐘,,制成藥粉復溶溶液,。將1瓶(1g/瓶)或2瓶(0.5g/瓶)復溶用注射器移液至同一個氯化鈉注射液瓶(100mL)中,混合均勻,,得到臨床藥液,。
上述樣品的制備是在生物安全柜下完成的。
2. 不溶性微粒檢測
①AccuSizer A2000 SIS不溶性微粒儀(PSS,,美國加利福尼亞州圣巴巴拉)檢測不溶性微粒,,AccuSizer 780 A2000 SIS 的參數(shù)如下:
檢測方法:SPOS
測定溫度:23℃
檢測體積:5 mL
檢測傳感器:LE400-05
檢測模式:Sum模式
檢測范圍:0.5–500 μm
標準顆粒:SIS Tri Mix STD(2 和 5μm)標準顆粒
②LS-200 不溶性微粒儀(PMS,博爾德,,科羅拉多州,,美國)檢測不溶性微粒,LS-200的參數(shù)如下:
檢測方法:光阻法
測定溫度:23℃
測定體積:5 mL
③掃描電子顯微鏡(SEM,,Nova NanoSEM 450,,F(xiàn)EI,Hillsboro,,OR)對不溶性微粒形態(tài)進行表征,。
樣品制備過程如下:將復溶后的頭孢唑林鈉注射液經(jīng)0.22 μm過濾器過濾,用水沖洗濾膜收集供試樣品進行顆粒測試,。然后,,首先將 100 μl不溶性微粒懸浮液鋪在蓋玻片上,在室溫下干燥過夜,。使用離子濺射機(SBC-12,,KYKY,北京,,中國)噴涂金屬涂層3分鐘,。
儀器參數(shù)設置如下:
加速電壓:1 kV,
工作距離:4.6 mm
探測器:背散射探測器(CBS)
3 實驗檢測結果
1. LS-200 不溶性微粒儀 VS AccuSizer A2000 SIS不溶性微粒儀
光阻法結果(LS-200 不溶性微粒儀)如表1所示,,雙腔袋A制劑小粒徑范圍內的顆粒數(shù)顯著低于小瓶包裝B制劑(p<0.001),,光阻法只能檢測≥2μm的不溶性微粒。SPOS結果(AccuSizer A2000 SIS不溶性微粒儀)顯示,三個廠家的不溶性微粒在各個粒徑范圍內均存在顯著差異,,雙腔袋A制劑小粒徑范圍內的顆粒數(shù)量明顯低于小瓶包裝的兩種制劑 B 和 C (p < 0.001),。不同廠家包裝形式的頭孢唑林鈉注射液溶液中不溶性微粒對比見表2、表3,,粒徑分布及對比見圖1,、圖2。

表1 頭孢唑啉鈉復溶后不同粒徑的不溶性微粒的比較(n=12)
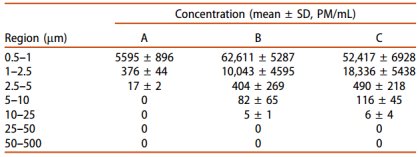
表2三個不同制造商的復溶溶液中不溶性微粒的測定結果 (n = 45),。

表3頭孢唑林鈉復溶后不同粒徑的不溶性微粒的比較(n =45)
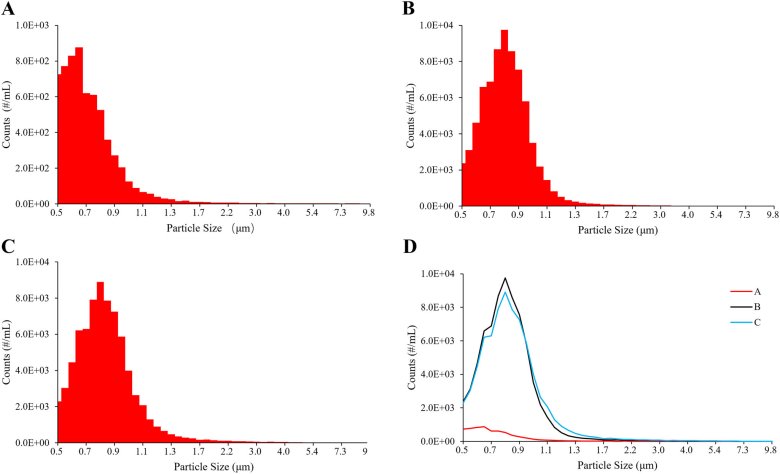
圖 1. (A) A 制劑,、(B) B 制劑和 (C) C 制劑復溶后不溶性微粒的分布。(D) (0.5–10 μm)顯示了不溶性微粒分布的比較,。
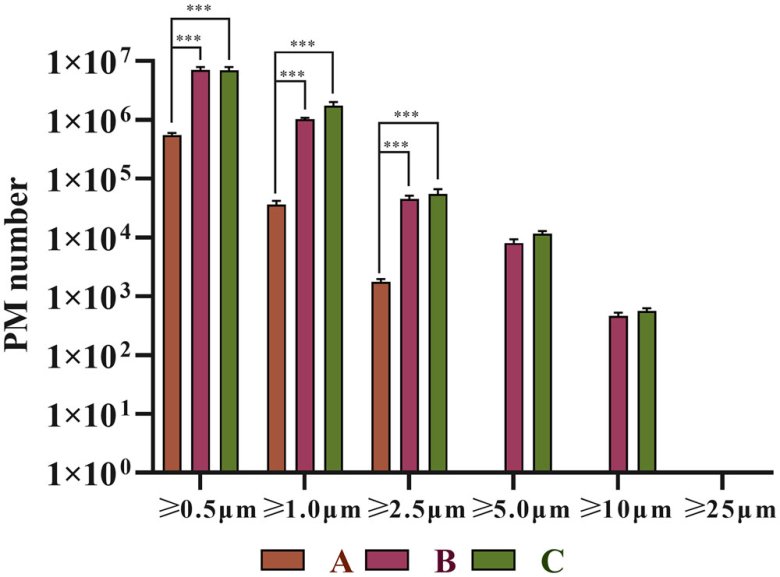
圖2 三個廠家頭孢唑啉鈉注射液輸液中不溶性微粒數(shù)比較(根據(jù)頭孢唑啉鈉注射液復溶后的體積(100 mL),,計算出三種制劑中不同粒度的不溶性微粒數(shù)量,與相同粒度范圍的制劑相比,,p<0.001),。
2.不溶性微粒形態(tài)評價
測試樣品的SEM結果如圖3所示:制劑A的不溶性微粒形狀規(guī)則,且存在少量小粒徑顆粒,。制劑A的顆粒呈立方體結構并且相對圓形,。制劑B和C的不溶性微粒形狀不規(guī)則,小粒徑顆粒數(shù)量較多,。顆粒形狀呈紡錘形,、條形、碎片形和多面體形,。
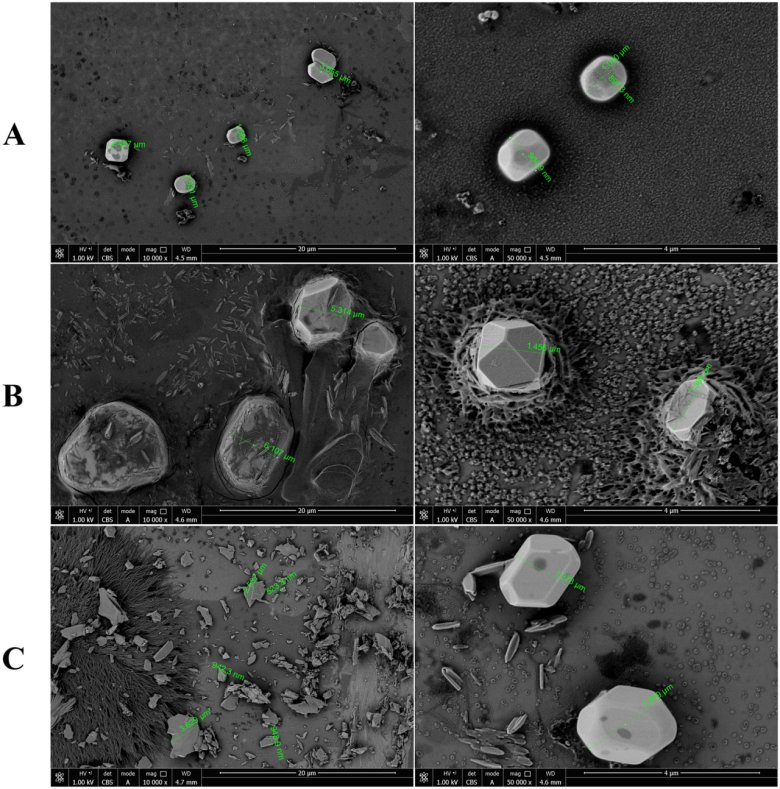
圖3 不同廠家頭孢唑啉鈉注射液復溶后不溶性微粒的SEM圖像,。(A)A制劑、(B)B制劑,、(C)C制劑,。左側圖像的放大倍數(shù)為 10,000 倍,,右側圖像的放大倍數(shù)為 50,000 倍,。
3 總結
檢測和控制注射產品中不溶性微粒的分布對于確保藥物安全性和有效性至關重要。大量研究表明,,小粒徑的不溶性微粒與血栓和炎癥等潛在的風險有關,。因此,對于小粒徑不溶性微粒的檢測是評估輸液產品安全性的一個重要指標,。
本文研究頭孢唑林鈉不同包裝形式對小粒徑不溶性微粒分布的影響,,使用了SPOS技術、傳統(tǒng)光阻法和SEM對不溶性微粒進行評估,。SPOS技術,,與傳統(tǒng)的光阻法(檢測>2 μm顆粒濃度)不同,可檢測到小至0.5 μm的亞可見顆粒。不同包材下復溶后產品的小粒徑(0.5~2.5 μm)不溶性微粒濃度存在顯著差異,,其結果與SEM結果一致,。
結果表明,雙腔袋包裝形式的小粒徑不溶性微粒的數(shù)量顯著低于傳統(tǒng)的小瓶(西林瓶)制備形式,。雙腔袋包裝形式可能是減少小粒徑不溶性微粒不良反應的有效替代方案,,對指導臨床合理用藥具有一定意義。
最新動態(tài)
更多




虛擬號將在 秒后失效
使用微信掃碼撥號