
馬爾文帕納科
 白金會員
白金會員 已認證
已認證

馬爾文帕納科
 白金會員
白金會員 已認證
已認證
本文摘要
在腫瘤治療中展現(xiàn)強大治療潛力的ADC藥物,其大規(guī)模商業(yè)化很大程度上是基于偶聯(lián)技術的突破,,更智能的連接子真正實現(xiàn)藥物的精準釋放,,讓ADC藥物的療效和安全性得到了顯著的提升,。為應對ADC藥物極高的研發(fā)成本,,降低失敗風險,表征關鍵質(zhì)量屬性(CQAs)是此類藥物研發(fā)生產(chǎn)的關鍵所在,。本文介紹了馬爾文帕納科貫穿ADC藥物研發(fā)全過程的多種表征技術及其在評估結(jié)合活性,、優(yōu)化穩(wěn)定性及控制顆粒形成等領域的相關應用,。
近年來,抗體偶聯(lián)藥物(Antibody-Drug Conjugates, ADCs)逐漸成為生物技術領域的明星產(chǎn)品,,其獨特的機制——結(jié)合抗體的靶向性與高毒性小分子藥物的強效殺傷力,,為癌癥治療提供了精準且高效的解決方案。根據(jù)最新數(shù)據(jù),,全球癌癥患者每年新增約2000萬例,,而ADC藥物已在腫瘤治療中展現(xiàn)出強大的治療潛力,。以Enhertu為例,2023年該藥物為其開發(fā)者阿斯利康(AstraZeneca)和第一三共(Daiichi Sankyo)帶來了25億美元的銷售收入,,成為多個ADC“重磅炸彈”藥物之一,。2023年,,全球ADC市場總規(guī)模首次突破百億美元大關,。 在中國市場,,ADC領域同樣發(fā)展迅猛,2024年多款ADC產(chǎn)品通過License-out模式實現(xiàn)了高額交易,為行業(yè)注入了強勁的增長動力,。
ADC藥物的崛起并非偶然,其成功得益于多年來生物技術的進步和創(chuàng)新,。單克隆抗體的研發(fā)已經(jīng)有近40年的歷史,,ADC所使用的高毒性藥物(如DNA和微管抑制劑)也有著長期的研究基礎。但真正推動ADC大規(guī)模商業(yè)化的是近年來偶聯(lián)技術的突破。
早期的連接子(linker)技術因化學穩(wěn)定性差而導致藥物在非特定位置釋放,,顯著縮小了治療窗口,。此外,連接子的容量有限,,也限制了抗體所能攜帶藥物的數(shù)量,。而過去10-15年中,隨著更智能的連接子被設計出來,,通過pH敏感性或靶細胞內(nèi)切割機制實現(xiàn)藥物的精準釋放,,ADC的療效和安全性得到了顯著提升。這些技術進步極大地擴展了ADC的治療窗口,,降低了藥物對健康組織的副作用,,同時最大化了對病變組織的打擊力度。
ADC藥物的研發(fā)成本極高,,同時面臨著失敗風險,。表征關鍵質(zhì)量屬性(CQAs)是降低研發(fā)風險、提高產(chǎn)品成功率的關鍵所在,。
01丨關鍵質(zhì)量屬性表征的挑戰(zhàn)與機遇
ADC藥物的成功依賴于多個因素,,包括抗體與抗原結(jié)合后的效果、藥物載荷對抗體穩(wěn)定性的影響,,以及聚集行為等,。其中,以下問題尤為關鍵:
偶聯(lián)對結(jié)合活性的影響:常用的賴氨酸偶聯(lián)策略可能改變抗體的結(jié)合區(qū)域,,從而降低藥物靶向性與療效,。
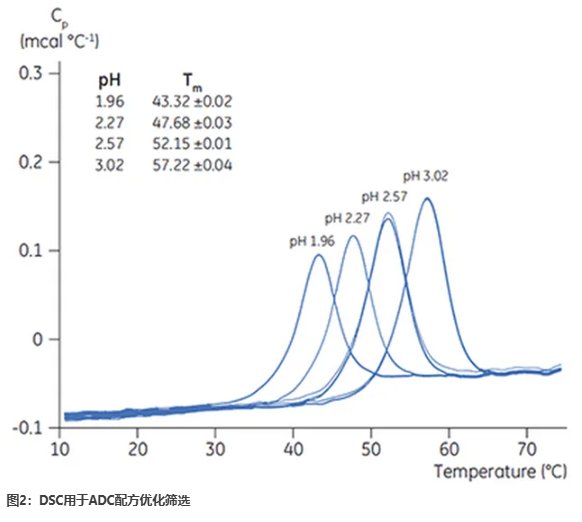
抗體穩(wěn)定性的降低:偶聯(lián)的高疏水性小分子藥物往往會影響抗體的結(jié)構(gòu)穩(wěn)定性,,增加聚集傾向,縮短藥物保質(zhì)期,。
亞微米顆粒的形成:亞微米顆??赡芤l(fā)免疫原性反應,是監(jiān)管機構(gòu)日益關注的重點,。
面對ADC研發(fā)中的復雜挑戰(zhàn),,馬爾文帕納科提供了一系列先進的表征工具,覆蓋研發(fā)全過程,,幫助企業(yè)科學應對問題并優(yōu)化開發(fā)效率,。


從研發(fā)到生產(chǎn)的全程支持
馬爾文帕納科的技術與專業(yè)知識貫穿ADC藥物的研發(fā)全過程,無論是評估結(jié)合部位與活性,、優(yōu)化穩(wěn)定性,,還是控制顆粒形成,都能為企業(yè)提供全面支持,。在這個充滿潛力的領域,我們助力研發(fā)企業(yè)在提高效率和質(zhì)量的同時,,降低研發(fā)失敗的風險,,幫助更多創(chuàng)新療法造福患者,。
相關產(chǎn)品
更多
相關文章
更多
技術文章
2025-06-10技術文章
2025-05-28技術文章
2025-05-23技術文章
2025-05-19
虛擬號將在 秒后失效
使用微信掃碼撥號