
貝克曼庫爾特商貿(mào)(中國)有限公司
 白金會員
白金會員 已認證
已認證

貝克曼庫爾特商貿(mào)(中國)有限公司
 白金會員
白金會員 已認證
已認證
無論是在學(xué)術(shù)研究領(lǐng)域還是在生物制藥工業(yè)中,選擇合適的啟動子實現(xiàn)高效的蛋白生產(chǎn),,在菌種和工藝開發(fā)中都起著至關(guān)重要的作用,。研究表明甲基營養(yǎng)酵母多形漢遜酵母(Hansenula polymorpha 或 Ogataea polymorpha)和畢赤酵母(Pichia pastoris)是異源基因表達的有效宿主微生物,,可大規(guī)模生產(chǎn)各種重組蛋白。它們之所以具有吸引力,,還因為它們使用甲醇作為唯一的碳源,,需要一套獨特的代謝酶,其生產(chǎn)受到嚴(yán)格控制 ,。[1] 由于其獨特的特性,,漢遜酵母廣泛用作重組蛋白生產(chǎn)的表達宿主:首先,相比有些哺乳動物的蛋白需要在37°C保持其生物活性,,漢遜酵母菌具有耐熱性,,有利于哺乳動物蛋白的生產(chǎn),。其次,,蛋白質(zhì)糖基化途徑的存在,使真核重組蛋白生產(chǎn)成為可能,,同時可以避免過度糖基化,。第三,其利用甲醇作為碳源的能力允許分離出強甲醇誘導(dǎo)型啟動子。此外,,多形漢遜酵母菌還可利用諸如甘油,、葡萄糖、木糖,、纖維二糖等其他碳源,。[2]
多形漢遜酵母菌能在甲醇培養(yǎng)基中產(chǎn)生大量醇氧化酶和甲醇代謝所需的其他酶。因此,,形成酶的液泡充滿了細胞的大部分胞內(nèi)空間,。研究人員利用這種獨特的性質(zhì),通過將目的基因連接至醇氧化酶基因?qū)崿F(xiàn)外源蛋白表達,。[3] 將外源基因連接至醇氧化酶基因的啟動子,,可獲得高水平重組蛋白。[1] 形漢遜酵母菌在理想培養(yǎng)條件下,,使用甲酸脫氫酶(FMD)或甲醇氧化酶(MOX)等強啟動子可獲得超高蛋白滴度,。甲基營養(yǎng)酵母的強分泌能力與成熟的高細胞密度發(fā)酵技術(shù)相結(jié)合,可使外源蛋白分泌量高達每升數(shù)克,。[4] 這兩種啟動子均被葡萄糖或乙醇強烈抑制,,而被甲醇作為唯一碳源高度誘導(dǎo)。如果甘油或葡萄糖的補料低于細胞生長限制速率,,則MOX啟動子不受抑制,。[1]
在本應(yīng)用中,我們使用微型生物反應(yīng)器BioLector探索漢遜酵母獲得高產(chǎn)量的綠色熒光蛋白(GFP)所需的PH條件,。在本高通量發(fā)酵研究中,,我們研究含有 FMD 和 MOX 啟動子的多形漢遜酵母菌種,以確定高效蛋白生產(chǎn)所需的首選 pH 范圍,。截至目前,,研究表明在小規(guī)模培養(yǎng)系統(tǒng)中低 pH 范圍 4-6 非常難以測定和控制。這里,,光學(xué) pH 傳感器是首選的測量系統(tǒng),。使用普通的傳感器往往只能在生理 pH 范圍內(nèi)提供可靠的結(jié)果。在本研究中,,我們將近期發(fā)布的低pH傳感器集成至 BioLector中,,以便進行可靠的非侵入式pH 篩選,實現(xiàn)發(fā)酵過程 pH 控制,,提高蛋白生產(chǎn)效率,。pH通過微孔板(MTP)中的微流控芯片控制,并在紅外光譜范圍進行光學(xué)測量,,以減少培養(yǎng)基中背景熒光的干擾,。這使得BioLector高通量微型發(fā)酵平臺可在低 pH 條件下使用熒光報告基因(如 GFP)跟蹤整個發(fā)酵過程的蛋白表達,。
方法
菌株
多形漢遜酵母RB11 MOX-GFP 菌株和 RB11 FMD-GFP 菌株
培養(yǎng)基
葡萄糖為碳源的無氨基酸酵母氮源培養(yǎng)基中(YNB-D)培養(yǎng):含有1.34g/L 酵母氮源、5g/L (NH4)2SO4和20g/L葡萄糖,。此外,,使用不同濃度(100mM、50mM 和 25mM)的磷酸鹽緩沖液(pH 6.0)
培養(yǎng)條件
在BioLector中采用微流控梅花板進行培養(yǎng),。振搖速度1200rpm,,溫度為 30°C。每孔培養(yǎng)體積 800μL,。以 3M NaOH和3M HCl作為pH調(diào)節(jié)劑,,通過微流控芯片在pH 4 –6范圍內(nèi)雙向調(diào)節(jié)pH。
在線測量參數(shù)
生物量,、GFP,、pH和溶氧
結(jié)果
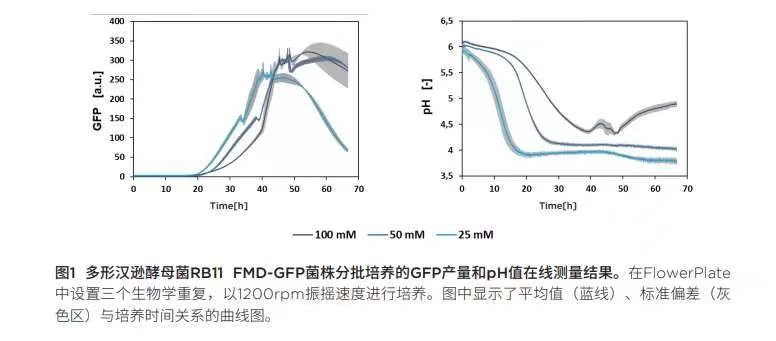
在不同緩沖液濃度的YNB-G培養(yǎng)基中進行分批培養(yǎng):通過預(yù)篩選實驗研究GFP對培養(yǎng)基中磷酸鹽緩沖液濃度和未調(diào)節(jié)pH值的依賴趨勢。為此,,在YNB-D中將漢遜酵母菌RB11 FMD-GFP 菌株進行分批培養(yǎng),,磷酸鹽緩沖液濃度調(diào)節(jié)為25mM、50mM 或 100mM,。GFP產(chǎn)量,、pH值與培養(yǎng)時間的關(guān)系如圖1所示。只要培養(yǎng)基中含有葡萄糖,,F(xiàn)MD啟動子就會受到抑制,,因此當(dāng)葡萄糖含量低或被完全消耗時,就會誘導(dǎo)GFP表達,。正如預(yù)期,,培養(yǎng)基緩沖液濃度越低,pH值下降越快,。相比,,低緩沖液濃度培養(yǎng)基中GFP產(chǎn)生的時間比高緩沖液濃度培養(yǎng)基更早。一個原因可能是低緩沖液濃度培養(yǎng)基滲透壓更低,,培養(yǎng)條件更好,,從而獲得更高的GFP產(chǎn)量。另一個原因可能是因為低緩沖液濃度培養(yǎng)基的pH值下降更快,,而這種低pH的環(huán)境在代謝生產(chǎn)力方面是更好的,。
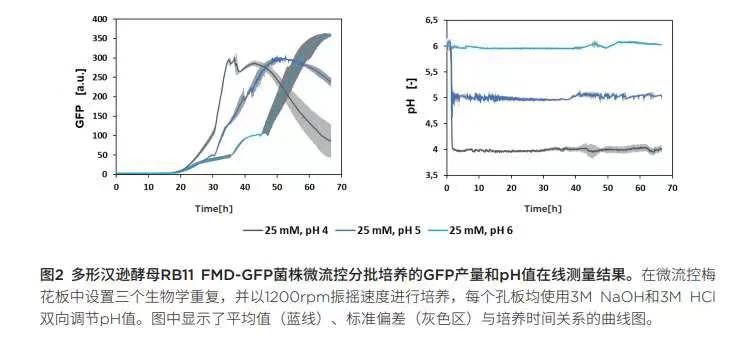
進行pH分析以尋求GFP高效表達的最佳條件:在接下來的多形漢遜酵母菌RB11 FMD-GFP菌株分批培養(yǎng)實驗中,使用緩沖液濃度為25mM的培養(yǎng)基,,并在培養(yǎng)過程中通過BioLector的微流控芯片技術(shù)調(diào)控pH值,。我們分析了pH在4.0- 6.5范圍的GFP 表達性能。圖 2顯示三組培養(yǎng)實例中GFP合成和pH控制情況,。從初步分批培養(yǎng)實驗中可以看出,,pH設(shè)定值越低,,GFP開始表達的時間就越早,。此外,,pH設(shè)定值越低,GFP信號的斜率越陡,。請注意,,在這里GFP只是目的蛋白質(zhì)的替代物,由于GFP在較低pH范圍內(nèi)不穩(wěn)定[5],,GFP在pH為4時的降解速度比在較高pH值時要快得多,,因此這里只能作定性比較。
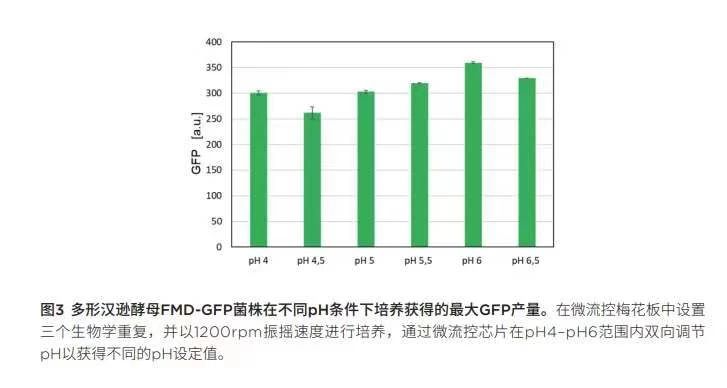
仔細觀察最大GFP信號(圖 3)以及隨后計算GFP表達的時空產(chǎn)率(圖 4),,每一項根據(jù)調(diào)整的PH設(shè)定值繪制,,證實了GFP在較低PH條件下表達較高的假設(shè)。盡管PH值為6時獲得最強GFP 信號(359.35 a.u.),,但GFP表達的時空產(chǎn)率(STY)仍呈現(xiàn)隨PH增大而降低的趨勢,。pH為4.0時獲得最高STY 10.24 I/mL*h。請注意,,GFP 只是目的蛋白質(zhì)的替代物,,由于GFP在較低PH范圍內(nèi)不穩(wěn)定[5],GFP 在PH為4時的降解速度比在較高PH值時要快得多,。

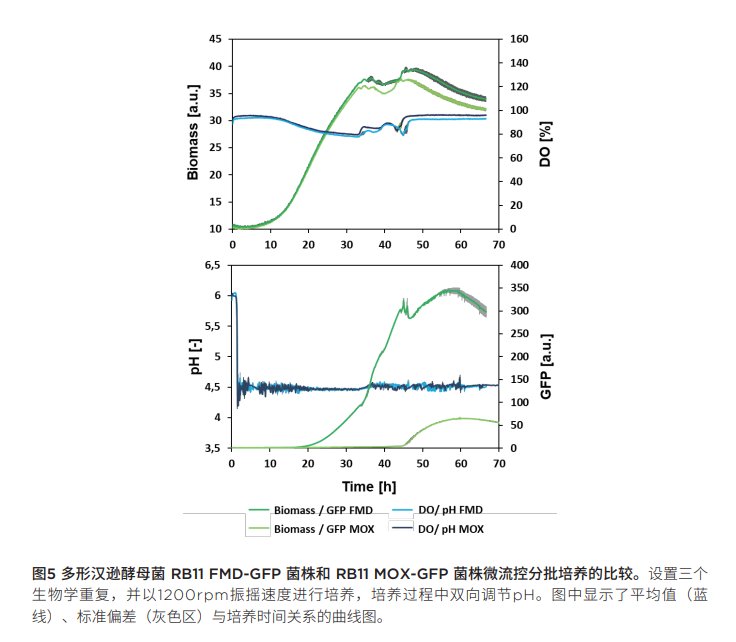
評估不同啟動子:對多形漢遜酵母RB11 FMD-GFP菌株和RB11 MOX-GFP菌的培養(yǎng)數(shù)據(jù)進行比較,,評估pH設(shè)定值固定為4.5的情況下GFP表達所用FMD和MOX 啟動子的特性。圖5為兩種株菌生物量和DO信號以及pH,、GFP值與培養(yǎng)時間關(guān)系的曲線圖,。從生物量和DO曲線上可看出,兩種菌株具有相似的生長行為,。但是,,GFP信號可以發(fā)現(xiàn),多形漢遜酵母菌RB11 FMD-GFP菌株的GFP信號高出7倍,。
結(jié)論
采用BioLector進行生物量,、GFP、pH 和 DO 的非侵入式在線測量,,可成功篩選出多形漢遜酵母蛋白表達的 pH 和菌株,。本研究發(fā)現(xiàn),較低pH 值和FMD 啟動子有利于 GFP 的表達(GFP 代表目標(biāo)蛋白質(zhì)),。此外,,基于BioLector的微流控技術(shù),可在一塊微孔板上同時進行多達32個不同條件的平行發(fā)酵以篩選漢遜酵母生產(chǎn)重組蛋白的最佳培養(yǎng)條件,。
參考文獻[1] Raschke, W., Neiditch, B., et al. (1996) Inducible expression of a heterologous protein in Hansenula polymorpha using the alcohol oxidase 1 promoter of Pichia pastoris. Elsevier Science Gene 177, 163-167. [2] Manfr?o-Netto, J., Gomes, A. and Parachin, N. (2019) Advances in Using Hansenula polymorpha as Chassis for Recombinant Protein Production. Front. Bioeng. Biotechnol. 7:94. doi: 10.3389/fbioe.2019.00094 [3] Kurtzman, C. & Robnett, C. (2010) Systematics of methanol assimilating yeasts and neighboring taxa from multigene sequence analysis and the proposal of Peterozyma gen.nov., a new membe rof the Saccharomycetales. FEMS Yeast Res 10, 353–361. [4] Hartner, F. & Glieder, A. (2006) Regulation of methanol utilisation pathway genes in yeasts. Microbial Cell Factories, 5:39. doi:10.1186/1475-2859-5-3 [5] Campbell, T. & Choy, F. (2001) The Effect of pH on Green Fluorescent Protein: A Brief Review, Molecular Biology Today 2 (1), 1-4.
相關(guān)產(chǎn)品
更多
相關(guān)文章
更多
技術(shù)文章
2025-05-23技術(shù)文章
2025-05-09技術(shù)文章
2025-02-28技術(shù)文章
2025-01-24