
貝克曼庫爾特商貿(mào)(中國)有限公司
 白金會(huì)員
白金會(huì)員 已認(rèn)證
已認(rèn)證

貝克曼庫爾特商貿(mào)(中國)有限公司
 白金會(huì)員
白金會(huì)員 已認(rèn)證
已認(rèn)證
細(xì)胞系在某些培養(yǎng)條件下可能形成弱聚集的團(tuán)聚體和更難分離的聚集體,,譬如人胚胎腎細(xì)胞(HEK)(1),。通過軟件算法準(zhǔn)確統(tǒng)計(jì)團(tuán)聚體和聚集體中的細(xì)胞數(shù)會(huì)有困難,可能會(huì)導(dǎo)致細(xì)胞計(jì)數(shù)不準(zhǔn)確,。為了減輕這種情況,,在取樣進(jìn)行分析之前,可能需要優(yōu)化樣品制備方法,,以消除或減少較大的團(tuán)聚體和聚集體(2),。Vi-CELL BLU細(xì)胞計(jì)數(shù)和活率分析儀集成了軟件功能,可以更準(zhǔn)確地對(duì)細(xì)胞團(tuán)塊進(jìn)行計(jì)數(shù),,在我們上一篇“團(tuán)聚細(xì)胞計(jì)數(shù)的應(yīng)用解決方案:Cell Type參數(shù)優(yōu)化”應(yīng)用短文中有更詳細(xì)的描述,。

如果軟件不能有效識(shí)別和統(tǒng)計(jì)團(tuán)聚體和聚集體中的細(xì)胞數(shù)量,Vi-CELL BLU細(xì)胞計(jì)數(shù)和活率分析儀軟件將統(tǒng)計(jì)這些較大的細(xì)胞簇,,并在圖像中用紅色方塊標(biāo)記它們(下圖3),。由于軟件對(duì)大型(有時(shí)是三維)細(xì)胞簇的細(xì)胞計(jì)數(shù)不準(zhǔn)確,所以其中的細(xì)胞沒有統(tǒng)計(jì),。但是,,軟件會(huì)統(tǒng)計(jì)并報(bào)告這些較大的細(xì)胞簇?cái)?shù)量。通過查看細(xì)胞簇的數(shù)量,,您可以檢查特定樣本的聚集程度,。由于大聚集體可能對(duì)懸浮細(xì)胞培養(yǎng)產(chǎn)生負(fù)面影響,原因包括代謝擴(kuò)散減少導(dǎo)致細(xì)胞生長不良,,以及質(zhì)粒和病毒顆粒無法到達(dá)內(nèi)部細(xì)胞,,引起轉(zhuǎn)染和轉(zhuǎn)導(dǎo)效率下降從而導(dǎo)致滴度降低(3),因此這種情況最好停止培養(yǎng),。如果檢測(cè)確定細(xì)胞簇不可接受,,但仍需要計(jì)數(shù),則可能需要建立新的樣品制備過程,。
對(duì)于在某些條件下難以分離聚集體的細(xì)胞系,,如一些HEK293細(xì)胞培養(yǎng),需要額外的團(tuán)聚分離優(yōu)化策略,,即得到分離良好的細(xì)胞懸液由Vi-CELL BLU細(xì)胞計(jì)數(shù)和活率分析儀檢測(cè),,從而實(shí)現(xiàn)更準(zhǔn)確的細(xì)胞計(jì)數(shù),。在本應(yīng)用短文中,我們描述了不同的分離介質(zhì)和移液吹打?qū)N壁HEK293細(xì)胞的聚集程度,、存活率和活細(xì)胞計(jì)數(shù)的影響。我們還提供了一種側(cè)樣制備技術(shù),,可以在Vi-CELL BLU細(xì)胞計(jì)數(shù)和活率分析儀上獲得更準(zhǔn)確的計(jì)數(shù)結(jié)果,,而無需改變傳代培養(yǎng)細(xì)胞的現(xiàn)有分離方法。
在第一個(gè)實(shí)驗(yàn)中,,測(cè)試了3種酶分離介質(zhì):胰蛋白酶,、含EDTA的胰蛋白酶和TrypLE。此外,,用1000μL移液槍上下吹打,,在單個(gè)樣品上測(cè)試每種分離介質(zhì)。在第二個(gè)實(shí)驗(yàn)中,,在初始胰蛋白酶處理后采集側(cè)樣本,,并用TrypLE處理。
分離介質(zhì)優(yōu)化過程
1,、HEK293細(xì)胞在T75細(xì)胞培養(yǎng)瓶中生長,,在含有10%FBS的DMEM中融合率>70%。
分別準(zhǔn)備兩個(gè)培養(yǎng)瓶,,用于測(cè)試胰蛋白酶,、TrypLE和胰蛋白酶-EDTA作為分離處理
2、移除培養(yǎng)基,,用5mL新鮮的無Ca2+,、Mg2+離子的DPBS沖洗單層細(xì)胞。
3,、加入2mL分離介質(zhì),,輕輕搖動(dòng)培養(yǎng)瓶以確保單層細(xì)胞完全被覆蓋。培養(yǎng)細(xì)胞在37°C和5% CO2下孵育2分鐘,。
注意:輕輕搖晃細(xì)胞上的培養(yǎng)基可以確保單層細(xì)胞完全被分離分離介質(zhì)覆蓋,,但是,敲擊或搖晃培養(yǎng)瓶太劇烈可能會(huì)導(dǎo)致大簇細(xì)胞立即被移除,。
4,、孵育2分鐘后,細(xì)胞完全從培養(yǎng)瓶中分離出來,,加入10毫升含有10%FBS的溫?zé)酓MEM,,用10mL移液槍上下吹打5次,輕輕混合,。
5,、接下來將3mL培養(yǎng)細(xì)胞轉(zhuǎn)移到四個(gè)5mL試管中,,將12mL培養(yǎng)細(xì)胞分開。
兩個(gè)試管被指定為未吹打?qū)φ?,兩個(gè)被指定為吹打后的樣品,。
-對(duì)于吹打好的樣品,用1000μL移液槍上下吹打1000μL懸浮液10次,。
6,、將試管輕輕翻轉(zhuǎn)3次進(jìn)行混勻,將5個(gè)200μL的重復(fù)樣本分配到Vi-CELL BLU細(xì)胞計(jì)數(shù)和活率分析儀樣品管中,,并在Vi-CELL BLU細(xì)胞計(jì)數(shù)和活率分析儀上測(cè)試結(jié)果,。
通過在樣品管和重復(fù)樣本之間交替分析吹打后樣品和未吹打?qū)φ掌返慕Y(jié)果。譬如,,吹打管1-重復(fù)1,,未吹打管1-重復(fù)1,吹打管2-重復(fù)1,,未吹打管2-重復(fù)1,。
7、通過使用Vi-CELL BLU細(xì)胞計(jì)數(shù)和活率分析儀上默認(rèn)設(shè)置和Mammalian細(xì)胞類型分析樣品,。
8,、對(duì)于每種分離介質(zhì),兩個(gè)培養(yǎng)瓶中的樣品檢測(cè)重復(fù)該流程,。

表1. 試劑清單
分離介質(zhì)優(yōu)化結(jié)果
與胰蛋白酶處理的樣品相比,,胰蛋白酶-EDTA和TrypLE處理的樣品的平均細(xì)胞簇?cái)?shù)量顯著降低(p<0.05;Student's t-檢驗(yàn)),,表明使用胰蛋白酶-EDTA和TrypLE進(jìn)行了更有效的細(xì)胞分離,。胰蛋白酶-EDTA和TrypLE處理的樣品細(xì)胞簇?cái)?shù)量相似,表明兩種分離介質(zhì)的性能相似,。胰蛋白酶-EDTA和TrypLE處理的樣品,,吹打能夠顯著降低細(xì)胞簇?cái)?shù)量(p<0.05;Student’s t-檢驗(yàn)),,表明通過移液槍吹打得到更弱的細(xì)胞簇,,然而,吹打不能分離胰蛋白酶處理樣品中的聚集體,。胰蛋白酶-EDTA和TrypLE的活細(xì)胞密度相似,,組間無顯著統(tǒng)計(jì)學(xué)差異(p>0.05;Student's t-檢驗(yàn)),。在所有情況下,,移液槍吹打都提高了存活率,這可能是由于在沒有團(tuán)聚體和聚集體的情況下采用了更有效的計(jì)數(shù)算法。
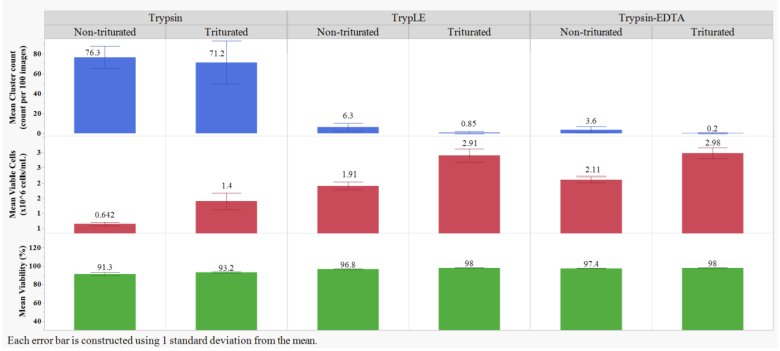
圖1: 三種分離介質(zhì)和吹打得到的平均細(xì)胞簇?cái)?shù)量,,平均活細(xì)胞密度和平均活率結(jié)果,。結(jié)果是每組所有試管和培養(yǎng)瓶的所有重復(fù)的平均值。使用JMP 16.1.0版對(duì)數(shù)據(jù)進(jìn)行分析,。
側(cè)樣品分離方法
1,、HEK293細(xì)胞在T75細(xì)胞培養(yǎng)瓶中生長,在含有10%FBS的DMEM中融合率>70%,。
準(zhǔn)備3個(gè)培養(yǎng)瓶來測(cè)試側(cè)樣品分離方法,。
2、移除培養(yǎng)基,,用5mL新鮮的無Ca2+、Mg2+離子的DPBS沖洗單層細(xì)胞,。
3,、然后,加入2mL胰酶介質(zhì),,輕輕搖動(dòng)培養(yǎng)瓶以確保單層細(xì)胞完全被覆蓋,。培養(yǎng)細(xì)胞在37°C和5% CO2下孵育2分鐘。
4,、孵育2分鐘后,,加入10 mL含有10%FBS溫?zé)岬腄MEM,用10mL移液槍上下吹打5次,,輕輕混合,。
5、接下來將3mL培養(yǎng)細(xì)胞轉(zhuǎn)移到四個(gè)5mL試管中,,將12mL培養(yǎng)細(xì)胞分開,。
兩個(gè)試管被指定為對(duì)照,另外兩個(gè)被指定為側(cè)樣品,。
將兩個(gè)對(duì)照管翻轉(zhuǎn)3次,,從每個(gè)管中取出3個(gè)200μL的樣品,并在Vi-CELL BLU細(xì)胞計(jì)數(shù)和活率分析儀上測(cè)試結(jié)果,。它們被指定為未經(jīng)處理的對(duì)照組,,代表了現(xiàn)有的傳代流程。剩余體積被指定為處理后的對(duì)照,。
將兩個(gè)側(cè)樣品管翻轉(zhuǎn)3次,,然后將所有4個(gè)管(兩個(gè)2400μL對(duì)照管和兩個(gè)3000μL側(cè)樣品管)在500 rcf下離心3分鐘使細(xì)胞沉淀。
6,、離心后取出培養(yǎng)基,,將細(xì)胞重新懸浮在400μL含10%FBS的DMEM(用于2個(gè)處理過的對(duì)照管)或500μL TrypLE(用于2側(cè)樣品管)中,然后用1000μL移液槍上下吹打10次以重新懸浮細(xì)胞。
7,、在室溫下孵育2分鐘后,,將樣品重新懸浮至初始體積(處理過的對(duì)照為2400μL,側(cè)面樣品為3000μL),。
8,、用1000μL移液槍上下吹打樣品10次混合,然后將試管翻轉(zhuǎn)3次,。
9,、接下來,從每根試管中取五個(gè)200μL的重復(fù)樣本,,在Vi-CELL BLU細(xì)胞計(jì)數(shù)和活率分析儀上測(cè)試,,在處理過的對(duì)照試管和側(cè)樣本試管之間以及重復(fù)樣本之間交替測(cè)試,每種情況共測(cè)試10次,。例如,,處理過的對(duì)照管1-重復(fù)1,側(cè)樣品管1-重復(fù)1,,處理過的對(duì)照管2-重復(fù)1,,側(cè)樣品管2-重復(fù)1。
10,、使用默認(rèn)設(shè)置和Mammalian細(xì)胞類型分析所有樣本,。對(duì)總共3個(gè)培養(yǎng)瓶重復(fù)該流程。
側(cè)樣品分析結(jié)果
TrypLE處理的側(cè)樣本的細(xì)胞簇?cái)?shù)量明顯低于未處理和處理的對(duì)照組(p<0.05,;Student's t-檢驗(yàn)),。經(jīng)過額外處理步驟的胰蛋白酶處理的對(duì)照組和經(jīng)TrypLE處理的樣本,VCD明顯高于未經(jīng)處理的對(duì)照組(p<0.05,;Student’s t-檢驗(yàn)),。處理過的對(duì)照組較高的VCD可能是由于額外的混合和移液步驟導(dǎo)致團(tuán)聚體分離開。額外的處理顯著降低了處理后對(duì)照組相比未處理對(duì)照組的存活率,,略微降低了1.5%(p<0.05,;Student's t-檢驗(yàn))。與未處理和處理的對(duì)照組相比,,TrypLE處理顯著提高了存活率(p<0.05,;Student's t-檢驗(yàn)),這可能是因?yàn)樵跊]有團(tuán)聚體的情況下計(jì)數(shù)更準(zhǔn)確,。
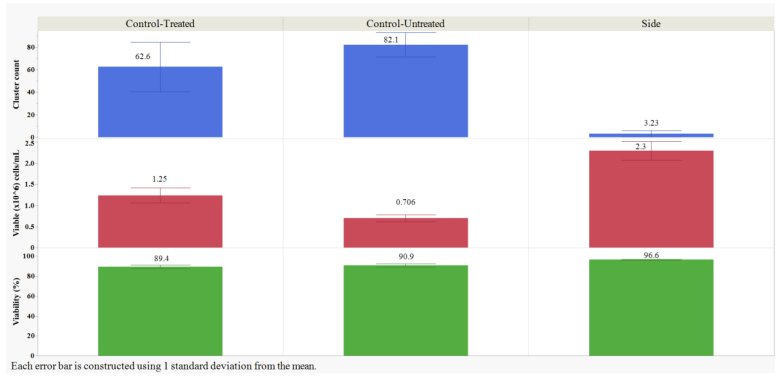
圖2: TrypLE處理后側(cè)樣品,,未處理對(duì)照和介質(zhì)處理后的對(duì)照。它們的平均細(xì)胞簇?cái)?shù)量,,平均活細(xì)胞密度和平均活率結(jié)果,。結(jié)果是每組所有試管和培養(yǎng)瓶的所有重復(fù)的平均值,。使用JMP 16.1.0版對(duì)數(shù)據(jù)進(jìn)行分析。
對(duì)圖像的回顧顯示了胰蛋白酶處理樣本存在大的紅色框標(biāo)記和一些較小的細(xì)胞團(tuán)聚體(圖3左圖),。TrypLE處理的側(cè)樣本(圖3右圖)顯示了很少的細(xì)胞簇和較少的細(xì)胞團(tuán)聚體,。
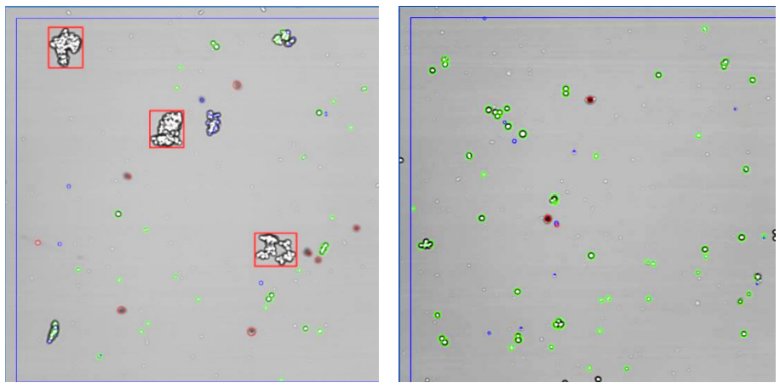
圖3: 胰酶對(duì)照組(左)和TrypLE處理后的側(cè)樣品(右)的圖像示例
討論
如前所述,分離方法的選擇會(huì)顯著影響存活率,、活細(xì)胞計(jì)數(shù)和聚集程度,。通過移液槍進(jìn)行溫和地吹打可能會(huì)分離弱聚集的團(tuán)聚體,并且允許在不降低細(xì)胞活率的情況下進(jìn)行更準(zhǔn)確的計(jì)數(shù),。對(duì)于更大,、更難分離且對(duì)移液槍吹打反應(yīng)不佳的細(xì)胞簇,用替代的分離介質(zhì),,譬如胰蛋白酶加EDTA或TrypLE,,可以使細(xì)胞懸浮液更加分離。
最后,,若繼續(xù)使用現(xiàn)有的分離方法,,也可以選擇使用側(cè)樣技術(shù),從而在Vi-CELL BLU細(xì)胞計(jì)數(shù)和活率分析儀上實(shí)現(xiàn)更準(zhǔn)確的計(jì)數(shù),。
● 參考文獻(xiàn):
1. Iuchi et al. Cytotechnology Feb 2020; 72(1): 131-140. Different morphologies of human embryonic kidney 293T cells in various types of culture dishes
2. ISO 20391-1:2018 Biotechnology – Cell Counting – Part 1: General guidance on cell counting methods
3. Tsap. Y et al. Biotechnology Progress 2000; 16(5): 809-814. Biomass and Aggregation Analysis of Human Embryonic Kidney 293 Suspension Cell Cultures by Particle Size Measurement
4. Drummen, N. Cell Type settings considerations for counting clumpy cells on the Vi-CELL BLU cell viability analyzer. Beckman Coulter application note. Content ID: 2023-GBL-EN-101699
相關(guān)產(chǎn)品
更多
相關(guān)文章
更多
技術(shù)文章
2025-05-23技術(shù)文章
2025-05-09技術(shù)文章
2025-02-28技術(shù)文章
2025-01-24