
丹東百特儀器有限公司
 鉆石會(huì)員
鉆石會(huì)員 已認(rèn)證
已認(rèn)證

丹東百特儀器有限公司
 鉆石會(huì)員
鉆石會(huì)員 已認(rèn)證
已認(rèn)證

Α-FeOOH,,呈黃色,,被稱為氧化鐵黃(簡(jiǎn)稱鐵黃),,鐵黃形貌多為針狀結(jié)構(gòu),具有較好的遮蓋力,、耐光性,、耐候性,、耐酸堿性以及吸收紫外光線等優(yōu)點(diǎn),被廣泛的應(yīng)用于皮革,、透明塑料,、閃光涂料、油墨,、顏料等方面,,除此之外在精細(xì)陶瓷,催化劑以及生物工程領(lǐng)域也有良好的應(yīng)用前景,。
由于氧化鐵黃在177℃以上時(shí),,將會(huì)失去結(jié)合水并轉(zhuǎn)化為氧化鐵紅,為了提高氧化鐵黃的耐熱性,,通常采用表面改性技術(shù),使氧化鐵黃在高溫下保持良好的穩(wěn)定性,。不同的改性方法,,使氧化鐵黃的表面帶電性發(fā)生改變。
Zeta電位是顆粒表面化學(xué)的體現(xiàn),,依賴于顆粒表面的化學(xué)組成和周圍溶液環(huán)境,,不同的pH下,體現(xiàn)的Zeta電位不同,。環(huán)境pH對(duì)于Zeta電位的影響是多種因素共同作用的結(jié)果,,首先,pH的改變影響顆粒表面基團(tuán)的離解平衡;其次,,溶液環(huán)境中[H]+和[OH]-離子濃度不同,,會(huì)影響這兩種離子在顆粒表面的吸附效果;最后,,滴定過(guò)程中加入酸或者堿不但會(huì)改變環(huán)境的pH還同時(shí)改變環(huán)境的離子強(qiáng)度,。在解釋滴定曲線的時(shí)候需要綜合考慮這些影響因素。

樣品制備和測(cè)試條件
將氧化鐵黃粉末分散在純凈水中得到母液,,水域超聲5分鐘使其分散,。檢測(cè)其pH為5.8,初始Zeta電位為正值,。通過(guò)BeNano主機(jī)和BAT-1自動(dòng)滴定儀進(jìn)行pH滴定操作,,向溶液中滴加NaOH水溶液改變體系的pH。終點(diǎn)pH設(shè)定為12,,pH間隔為1,,冗余度0.2pH值。
通過(guò)BeNano內(nèi)置的溫度控制系統(tǒng)開(kāi)機(jī)默認(rèn)測(cè)試溫度控制為25℃±0.1℃,,采用毛細(xì)管電極進(jìn)行測(cè)試,。每一個(gè)樣品在放入樣品池后進(jìn)行一次測(cè)試,。
測(cè)試結(jié)果和討論
通過(guò)檢測(cè)不同pH下樣品的Zeta電位值,我們得到Zeta電位隨pH的變化曲線,。
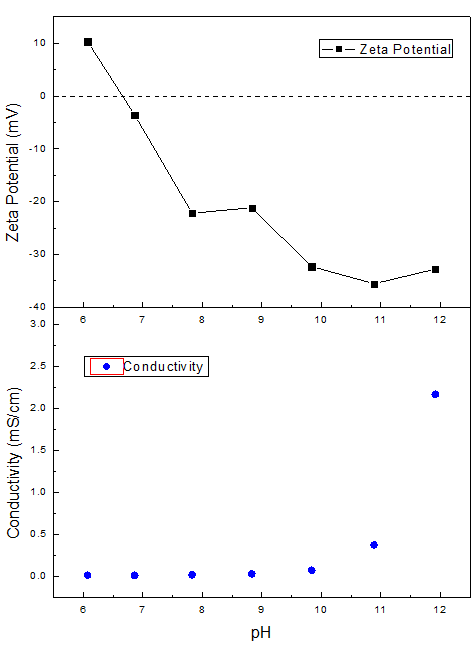
圖 | Zeta電位(上圖)和電導(dǎo)率(下圖)對(duì)于pH的依賴性曲線
從圖中可以看出,,氧化鐵黃樣品在低pH范圍時(shí)Zeta電位為正值,說(shuō)明其顆粒物上帶有較多正電,,隨著pH升高,,Zeta電位逐漸向0趨近,在pH=6.66時(shí)達(dá)到等電點(diǎn),,此時(shí)Zeta電位值為0,。隨著pH繼續(xù)升高,[OH]-濃度升高,,顆粒開(kāi)始攜帶負(fù)電荷,,其Zeta電位隨pH升高絕對(duì)值逐漸增大。
相對(duì)較高的pH(10~12)范圍(顆粒攜帶較多負(fù)電)懸浮液的Zeta電位絕對(duì)值比較高,,說(shuō)明體系在此范圍內(nèi)相對(duì)比較穩(wěn)定,,不容易團(tuán)聚,而在等電點(diǎn)附近Zeta電位較低,,體系的穩(wěn)定性相對(duì)較差,。
當(dāng)pH達(dá)到11之后,顆粒表面的負(fù)電荷基本達(dá)到飽和,,即使pH繼續(xù)升高,,顆粒表面也無(wú)法攜帶更多負(fù)電荷。此時(shí)繼續(xù)加入NaOH溶液在pH升高的同時(shí),,離子強(qiáng)度也逐漸升高,。在顆粒表面電荷基本飽和的情況下,Zeta電位絕對(duì)值不再變高,,而且隨離子強(qiáng)度加大,,電導(dǎo)率迅速上升,屏蔽效應(yīng)逐漸增加,,Zeta電位絕對(duì)值有緩緩變小的趨勢(shì),。
結(jié)論
通過(guò)百特BeNano納米粒度及Zeta電位儀和BAT-1自動(dòng)滴定儀表征了一個(gè)氧化鐵黃樣品在不同pH條件下的Zeta電位信息。結(jié)果表明,,氧化鐵黃在pH=6.66時(shí),,為其體系的等電點(diǎn),在等電點(diǎn)附近Zeta電位絕對(duì)值相對(duì)較低,,體系處于不穩(wěn)定狀態(tài),。而當(dāng)較高(pH=10~12)時(shí)其體系的Zeta電位絕對(duì)值較高,處于相對(duì)穩(wěn)定狀態(tài),。

最新動(dòng)態(tài)
更多





虛擬號(hào)將在 秒后失效
使用微信掃碼撥號(hào)