沈興志
珠海歐美克儀器有限公司產(chǎn)品經(jīng)理,,中國顆粒學會青年理事,全國顆粒表征與分檢及篩網(wǎng)標委會顆粒分技術委員會委員,,具有超過20年的光學分析儀器的技術工作經(jīng)驗,。主要從事粒度分析儀、Zeta電位分析儀,、光譜儀等光學儀器在多種不同領域的應用解決方案研究和開發(fā)、技術支持,、應用培訓和推廣等方面工作,,并參與相關儀器的開發(fā)和完善。協(xié)助分析儀器需求者開發(fā)和優(yōu)化合適的測試方法,,使測試結果更可靠,。提供分析儀器在產(chǎn)業(yè)鏈中的質控方法的管理和質量信息的傳遞的技術咨詢和服務,使分析儀器能發(fā)揮其最佳的性能和社會效益,。
1962年全球首個藥品生產(chǎn)質量管理規(guī)范(GMP)誕生于美國,,隨后,在GMP理論和實踐的“不斷發(fā)展和完善”中,,其在藥品生產(chǎn)質量保障中的積極作用逐漸被各國監(jiān)管機構接受,。例如中國《藥品生產(chǎn)質量管理規(guī)范》(2010年修訂)就規(guī)定GMP“作為質量管理體系的一部分,是藥品生產(chǎn)管理和質量控制的基本要求,,旨在最大限度地降低藥品生產(chǎn)過程中污染,、交叉污染以及混淆、差錯等風險,,確保持續(xù)穩(wěn)定地生產(chǎn)出符合預定用途和注冊要求的藥品,。”

在2020年,,美國FDA發(fā)起了一項題為“21世紀的藥物cGMP:基于風險管理的方法”倡議,,以鼓勵實施現(xiàn)代、科學和基于風險的藥物質量評價體系,。該倡議的目標是在確保監(jiān)管審查合規(guī)的基礎下支持制藥工業(yè)的持續(xù)創(chuàng)新,,推動藥品生產(chǎn)的高效靈活發(fā)展,即在不過度監(jiān)管的情況下生產(chǎn)高質量的藥品,。使用激光粒度儀對原料藥,、輔料和復合制劑內顆粒物等的粒徑進行的評價,,直接關系到藥物的溶出(釋放)藥效和制劑的穩(wěn)定性等多種關鍵產(chǎn)品質量。在藥品生產(chǎn)企業(yè)中,,如何將激光粒度儀納入其質量管理體系以符合監(jiān)管要求和提高產(chǎn)品質量是眾多管理人員十分關切的問題,。
FDA的工業(yè)設計指南和ICH的Q8、Q9,、Q10,、Q11和Q12將生命周期管理模型應用于分析方法,從科學和質量風險管理應用中獲得知識,,用于持續(xù)改進和保證方法產(chǎn)生數(shù)據(jù)的質量,,這其中包括了將分析方法生命周期管理應用到GMP生產(chǎn)相關的分析方法開發(fā)、改進,、驗證,、轉移和維護活動。
2016年至2017年期間,,美國藥典的驗證專家在PF上發(fā)表了四篇與分析方法生命周期相關的重要文章:
《分析程序的生命周期管理:方法開發(fā),、程序性能鑒定和程序性能驗證》
《適用性:決策規(guī)則和目標測量不確定度》
《分析控制策略》
《分析目標概要:整個分析生命周期的結構和應用》。
這四篇文章中基本概括了關于分析方法生命周期中的一些重要概念,,本文及后續(xù)的系列文章結合目前中國藥典論壇,、美國藥典論壇、專業(yè)雜志發(fā)表的相關文章,,以及歐美克激光粒度儀在醫(yī)藥行業(yè)的應用實踐,,簡單介紹一下激光粒度儀分析方法的質控管理及在GMP合規(guī)性體系中的應用。
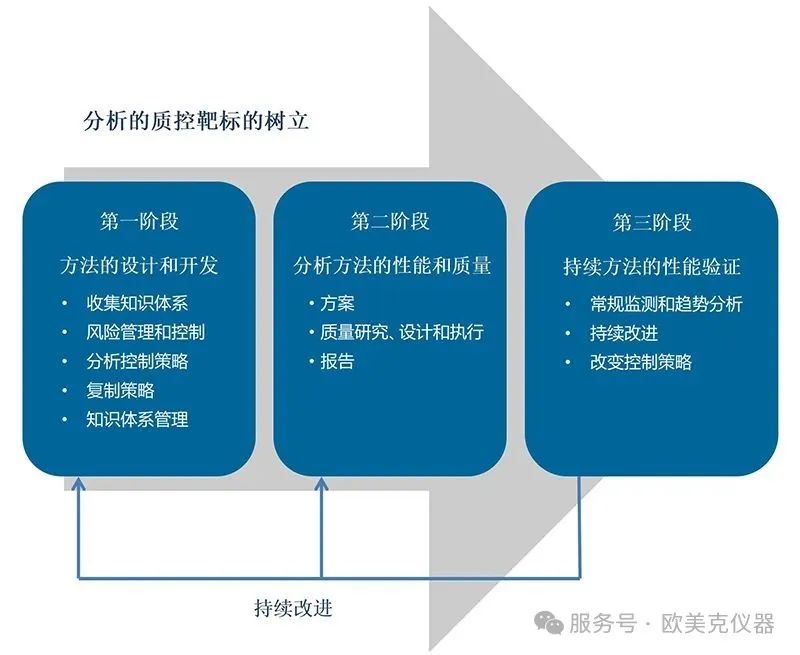
任何的分析測試的目的都是為了獲得穩(wěn)定,、可靠和準確的數(shù)據(jù),,用以直接或間接反映物料、產(chǎn)品的質量,,分析測試結果的可靠性,,即數(shù)據(jù)的質量和有效性對這一目的的實現(xiàn)是至關重要的。藥品生產(chǎn)企業(yè)在激光粒度儀的部署和質控應用中有一系列相應的GMP相關程序要求,,即廣義上通常被稱為“驗證”,,以使得該分析測試能實現(xiàn)“控制生產(chǎn)工藝過程,確保質量”,。
中國《藥品生產(chǎn)質量管理規(guī)范》(2010年修訂)對“驗證”的定義為:“證明任何操作規(guī)程(或方法),、生產(chǎn)工藝或系統(tǒng)能夠達到預期結果的一系列活動�,!痹诩す饬6葍x在實驗室管理體系的應用實踐中,,一般涉及的主要內容包括:分析儀器的確認,計算機化系統(tǒng)的規(guī)范,分析方法驗證等,。
GMP不會對相關驗證活動進行事無巨細的規(guī)定,,他只是質量管理體系的最基本要求,所以具體的分析測試如何與法規(guī)相兼容有很多的實現(xiàn)方式和優(yōu)化的空間,,以下內容我們結合歐美克激光粒度儀在醫(yī)藥生產(chǎn)中應用經(jīng)驗與讀者分享一些實踐經(jīng)驗,。
分析儀器的確認
分析儀器確認(AIQ, analytical instrument qualification)是證明和記錄某個儀器表現(xiàn)得適合其預定用途的文件證據(jù)的匯總,通常包括設計確認(DQ),,安裝確認(IQ),,運行確認(OQ),性能確認(PQ)四個方面(4Q),。應用4Q確認已日臻完善,,并得到許多實驗室的認同,在分析中使用確認過的儀器保障了對所生成的質量數(shù)據(jù)的有效性的信心,。
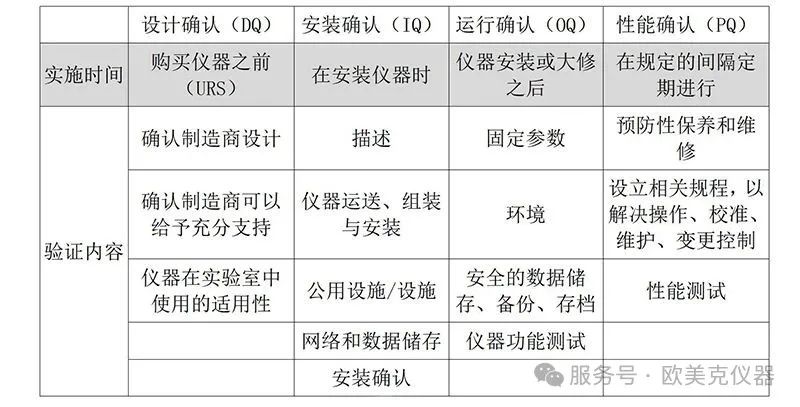
▲ 表1. 分析儀器確認每個階段的時間表,、實用性、活動
許多分析實驗室在以標準物質和/或校準標準品進行標準化的粒度儀上進行他們的測試,。有時候還要求加入質量控制檢驗參考樣品,,以便對此未來測試的適當表現(xiàn)提供中間或持續(xù)的保證。在這個方面,,在分析員進行該測試之前,,AIQ和分析方法驗證就對分析質量起到了作用,。系統(tǒng)適用性測試和質量控制檢查,,則在樣品分析馬上開始之前或在其過程中,幫助確保分析結果的質量,。
設計確認(DQ)
設計確認是基于儀器預定用途,,對儀器的功能與操作標準和供應商的選購標準(例如URS文件)做出響應確認的活動總匯,并以文件記錄,。設計確認(DQ)不僅可以由儀器開發(fā)者或制造商進行,,也可以由使用者進行。
制造商通常負責分析儀器的穩(wěn)健設計和維護,,描述該分析儀器的制造(設計標準,、功能要求等)、校準和測試驗證的內容,。雖然如此,,使用者仍應該確保商用成品儀器適用于他們的預定用途,并且制造商具備能夠保證儀器可靠的質量系統(tǒng),,使用者也應該確定制造商在輔助安裝,、服務、培訓方面的能力。確定的過程可以借助使用者以前與制造商的互動交流,。
安裝確認(IQ)
安裝確認(IQ)是對用于確定某個儀器按照設計和規(guī)定的方式運輸并正確安裝在選定的環(huán)境中,,以及該環(huán)境適合于此儀器所必需的活動總匯,并以文件記錄,。通常與IQ相關的活動和文件包括:
描述——提供該儀器或者儀器組成部分匯總的描述,,包括其制造商、型號,、編號,、軟件版本、放置位置,,適當情況下使用圖紙和流程圖,。
儀器運輸—— 確保該儀器、軟件,、手冊,、供給品,以及其他儀器附件的確認,。
公用設施/設施/環(huán)境的確認,。
組裝和安裝——組裝和安裝儀器,并進行任何預診斷和測試,。組裝和安裝可以由其制造商,、供應商、專業(yè)工程師,、或有資質的內部員工來進行,。對于儀器的驗收,制造商既定的安裝調試和驗證指導提供了具有價值的基本參考并根據(jù)用戶的具體標準進行補充,,在組裝和安裝過程中觀察到的任何異常事件均需以文件記錄,。
網(wǎng)絡和數(shù)據(jù)儲存的檢查和確認。
安裝確認——進行儀器的初始化診斷和測試相關軟硬件功能的確認,。

▲ 歐美克Topsizer 激光粒度分析儀
● 測試范圍:0.02-2000μm(濕法)0.1-2000μm(干法)
● 重復性:優(yōu)于0.5%(標樣D50偏差)
● 準確性:優(yōu)于0.6%(標樣D50偏差)
運行確認(OQ)
運行確認(OQ)是證實某個儀器將會在選定的環(huán)境中按照其操作規(guī)范運行所必需的活動總匯,,并以文件記錄。在OQ階段的測試活動包含了:
固定參數(shù)——這些測試測量該儀器的不變參數(shù),,例如長度,、高度、重量,、輸入電壓,、可接受壓力、載荷等,。如果由制造商提供的這些參數(shù)的規(guī)格令用戶滿意,,可以放棄測試要求。這些測試亦可以在IQ階段進行。
安全數(shù)據(jù)存儲,、備份,、存檔、審計追蹤的確認,。
儀器功能測試——用于確認在用戶環(huán)境中該儀器根據(jù)其規(guī)范的運行情況,。
性能確認(PQ)
性能確認(PQ)是證實某個儀器持續(xù)地按照由用戶定義的規(guī)范運行,并適合其預定用途的活動總匯,,并以文件記錄,。在IQ和OQ已經(jīng)執(zhí)行之后,該儀器對其預定用途的持續(xù)適用性通過性能確認來證實,,包括:
性能檢查——設立一個或一系列測試,,以確認具有滿足分析儀器預定用途的表現(xiàn)。PQ測試通�,?梢砸砸阎慕M分或標準物測試進行,,該測試應該具備良好的科學基礎并反映該儀器的一般用途。PQ測試可以選取在OQ中進行的那些測試,,但是如果需要,,其結果的質量標準可以設定得不同,盡管如此,,使用者對于PQ測試的標準應該證實儀器在其用途上的無故障運行,,例如對代表性的質量差異的已知參考品的測試驗證。
運行,、校準,、維護、變更控制的操作規(guī)范——建立維護和校準儀器的操作規(guī)范,。歐美克系列粒度儀經(jīng)過出廠前校準之后無需用戶再次校準,,其高性能硬件和優(yōu)化的光學設計使得測試結果始終可靠,,使用者可以采用已知參考樣根據(jù)質量控制需要按規(guī)程進行驗證即可,。對于需要校準的分析儀器,每次校準活動均應以文件記錄,,并對校準前后的分析數(shù)據(jù)質量評價性能進行評估以防范風險,。
當儀器硬件或軟件發(fā)生變更時
當制造商增加新功能并更正已知缺陷,儀器的軟硬件變更成為無可避免的事情,。但是所有這些變更可能不會總是令使用者獲益,,因此,使用者應該采納他們認為有用或必須的變更,,并且還應該評價變更的效果,,以確定是否需要以及需要什么樣的再確認。可以采用變更控制程序做這些工作,。