�Ї�(gu��)���w�W(w��ng)Ӎ Ŀǰ���ш�(b��o)�����Ҝ���x��늌�(d��o)�ʽӽ��������^(gu��)Һ�B(t��i)늽��|(zh��)ˮƽ(10-2 S cm-1)���̑B(t��i)늽��|(zh��)��������늽��|(zh��)������늽��|(zh��)�@���(l��i)����,��Ȼ��,��������̑B(t��i)늽��|(zh��)�������䳬�ߵğ��Y(ji��)�ضȺ��^��ęC(j��)е�ӹ����ܣ�����̑B(t��i)늽��|(zh��)�t����늻��W(xu��)�����^խ,���c���O���ϼ������^��,�����ڳ���h(hu��n)���O�ֽ�a(ch��n)��H2S���w�������������̑B(t��i)늽��|(zh��)���ڵ�������(w��n)�}����������?c��)�ȫ�̑B(t��i)늳��I(l��ng)��đ�(y��ng)��,��
�u������̑B(t��i)늽��|(zh��)���Ҝ��µ��x��늌�(d��o)�����_(d��)��10-3 S��cm-1,������Փ�x��늌�(d��o)�ʿ��_(d��)10-2 S��cm-1����(j��)����Փģ�M�Y(ji��)������,����������̑B(t��i)늽��|(zh��)���u����һ������^�ߵ�����߀ԭ�λ(�Ȼ���>4 V vs.Li/Li+,��������>6 V vs.Li/Li+),���c�߉����O���Ͼ��и��õļ����ԣ����Ԍ�(sh��)�F(xi��n)�ڸ�늉������µķ�(w��n)��ѭ�h(hu��n),��

�о��Ј�(b��o)�����u����늽��|(zh��)��늻��W(xu��)�����λ
�u����̑B(t��i)늽��|(zh��)�İl(f��)չ�^(gu��)��
�u����̑B(t��i)늽��|(zh��)һ����ָ�����u����x�ӿ�ܵ��x�ӌ�(d��o)�w,��1930���u���(LiX��X=F,��Cl,��Br��I)�ѽ�(j��ng)���C�����е͵���x��늌�(d��o)��,�,����ڴˣ�Rao������1969���(b��o)������LiI����늽��|(zh��)��Li/LiI/I�cLi/LiI/AgI/Ag�̑B(t��i)�늳�,��Ȼ��,��ԓ늳����������O�c늽��|(zh��)����l(f��)���ć�(y��n)�ؘO����(d��o)�o(w��)������(f��)���늡�
1976�꣬��һ�N���͵�LiAlCl4�u����̑B(t��i)늽��|(zh��)��Weppner�����_(k��i)�l(f��)����늳�ϵ�y(t��ng),����Ȥ����,������LiAICl4��174��r(sh��)�@ʾ��3.5X10-4 S cm-1���x��늌�(d��o)�ʶ����ȱ����ڟ�늳ء�
��1992��,��LixTiS2|LiAlCl4|Li1-xCoO2ȫ�̑B(t��i)�늳ر�Plichta���˳ɹ��M�b,��������100���¿���ѭ�h(hu��n)���^(gu��)150�Ρ�
1980�����1990���,���о��߂����^�_(k��i)�l(f��)���Զ��r(ji��)�����(y��ng)�x��(Mg,��Pb��Fe,��Mn��)�����ļ⾧ʯ���u����̑B(t��i)늽��|(zh��),���������Ҝ��x��늌�(d��o)���^�ͣ������ڸߜ��±��F(xi��n)��10-2 S cm-1�ĸ��x��늌�(d��o)��,��
���˺��ж��r(ji��)�����(y��ng)�x�ӵ��u����̑B(t��i)늽��|(zh��),���������r(ji��)�����(y��ng)�x�ӵ��u����̑B(t��i)늽��|(zh��)(��Ҫ����Sc��Y��La-Lu�ĵ�3��Ԫ��,���Լ�Ga��In�ĵ�13��Ԫ��)Ҳ���о��߂����m(x��)̽��,��
Li3InBr6����1998���ԁ�(l��i)�о������u����̑B(t��i)늽��|(zh��)���@����?y��n)��mȻ�Ҝ���Li3InBr6���x��늌�(d��o)���^��,�������ڸߜذl(f��)����׃��a(ch��n)���ĸߜ������10-3Scm-1���x��늌�(d��o)��,��Ȼ������-13���¸ߜ����֕�(hu��)�D(zhu��n)׃?y��u)�͜����ʧȥ�ߵ��x��늌�(d��o)��,���ʲ�̫�m�ό�(sh��)�H��(y��ng)��,��
�mȻ�u����̑B(t��i)늽��|(zh��)�İl(f��)չ�r(sh��)�g���L(zh��ng)�������c��ͬ����l(f��)�F(xi��n)�������(l��i)�̑B(t��i)늽��|(zh��)�������,�����^�͵��x��늌�(d��o)��ʹ���u����̑B(t��i)늽��|(zh��)���^(gu��)ȥʮ�����еİl(f��)չ�ܾ���,��
ֱ��2018�꣬Asano����ȡ�����ش�l(f��)�F(xi��n),����Li3YCl6��Li3YBr6�u����̑B(t��i)늽��|(zh��)���Ҝ��x��늌�(d��o)�ʷքe��5.1X10-4Scm-1��1.7X10-3Scm-1,��
�S�������N���и��x��늌�(d��o)�ʵ��u����̑B(t��i)늽��|(zh��)Ҳ���о��߂��l(f��)�F(xi��n),���磺Li3ErCl6(1.7X10-5 S cm-1~3.3X10-4 S cm-1),��Li3InCl6(8.4X10-4 S cm-1~2.04X10-3 S cm-1)��Li3-xM1-xZrxCl6(M=Y,��Er,��1.4X10-3 S cm-1)��Li3ErI6(3.9X10-4 Scm-1~6.5X10-4 Scm-1)��
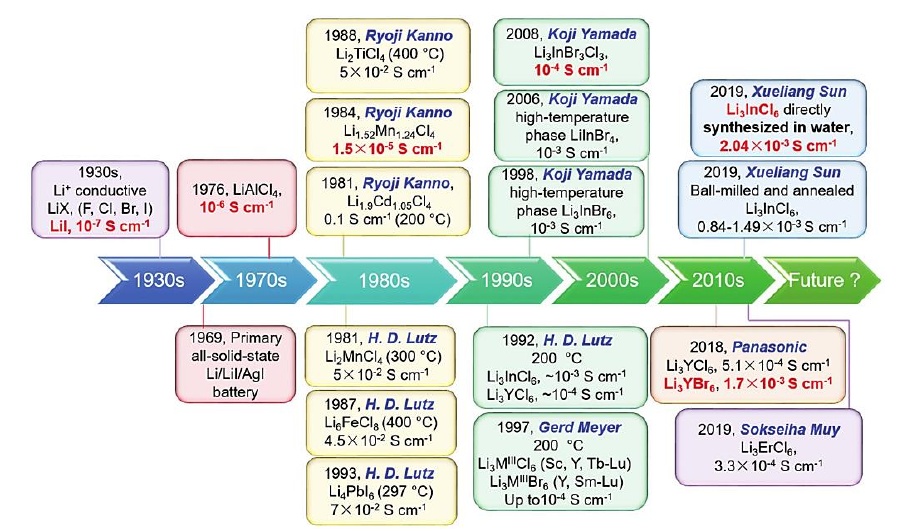
�u����̑B(t��i)늽��|(zh��)����Ҫ�l(f��)չ�r(sh��)�g�c(di��n)
�u����̑B(t��i)늽��|(zh��)�ĽY(ji��)��(g��u)
����(j��)MԪ�ص��x�Ӄr(ji��)�B(t��i)��ͬ,���u����̑B(t��i)늽��|(zh��)���Է֞����(l��i)��
��1��MԪ�ص��x�Ӄr(ji��)�B(t��i)����r(ji��)��M=V,��Cr,��Mn��Zn�ȣ�,��
��2��MԪ�ص��x�Ӄr(ji��)�B(t��i)�����r(ji��)��M=Sc,��Y��La-Lu,��Al,��Ga��In��,��
��3��MԪ�ص��x�Ӄr(ji��)�B(t��i)���ăr(ji��)��M=Zr,��Hf����
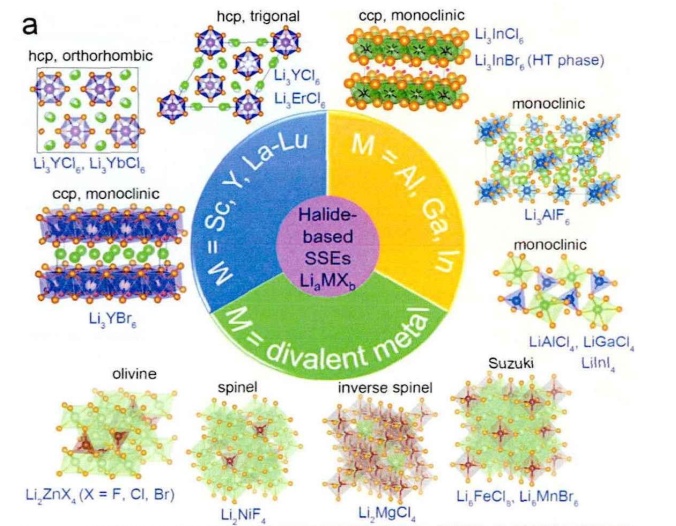
�u����L(f��ng)iaMXb���͞����Ԫ��,��X=F、Cl、Br、I���̑B(t��i)늽��|(zh��)�ķ��(l��i)
��1��M Ԫ�ص��x�Ӄr(ji��)�B(t��i)����r(ji��)��M=V,��Cr��Mn,��Zn �ȣ�
���(l��i)�̑B(t��i)늽��|(zh��)���սY(ji��)��(g��u)��Ҫ�֞���(l��i)���ϙ�ʯ�Y(ji��)��(g��u)�ͼ⾧ʯ�Y(ji��)��(g��u)�����⾧ʯ,�����⾧ʯ��ȱ���ͼ⾧ʯ����
�������ɷN�Y(ji��)��(g��u)��,���ϙ�ʯ�Y(ji��)��(g��u)��Ψһ����X-��x�������ܶѷe�ĽY(ji��)��(g��u),�������������ϵ�����gȺ��Pnma,���������|(zh��)��L(zh��ng)i2ZnCl4,���������е�Li+ռ��(j��)�����wλ�ã�Zn2+ռ��(j��)�����wλ��,���ϙ�ʯ�Y(ji��)��(g��u)��Li2ZnCl4��һ�N�ߜ���Y(ji��)��(g��u),�������⾧ʯ�Y(ji��)��(g��u)��Li2ZnCl4�ӟᵽ215�����ϵõ���
�⾧ʯ�Y(ji��)��(g��u)���u����̑B(t��i)늽��|(zh��)�ĽY(ji��)��(g��u)��ܻ���X-��x�ӵ������ܶѷe�Y(ji��)��(g��u),����Ҫ��ʽ��L(zh��ng)i2MX4��X=Cl,��Br�������⾧ʯ�Y(ji��)��(g��u)�����е�Li+ռ��(j��)�����wλ�ã�Li+�c�u����x�ӳ�����λ�P(gu��n)ϵ��,�����⾧ʯ�Y(ji��)��(g��u)�У�һ���Li+ռ��(j��)�����wλ�ã��c�u����x�ӳ�����λ�P(gu��n)ϵ��,����һ���Li+�Ͷ��r(ji��)�(y��ng)�x��һ��ռ��(j��)�����wλ�ÿ��Ա��_(d��)��(Li)tetr(LiM)octX4,��ȱ���ͼ⾧ʯ��ָLi2-2xM1+xCl4�����w��
�͜�Li2ZnCl4��һ�N���͵ľ������⾧ʯ�Y(ji��)��(g��u)���u����̑B(t��i)늽��|(zh��),�����gȺ��Fd-3m,���������е�Li+ռ��(j��)�������wλ�ã�Li+��늽��|(zh��)��ͨ�^(gu��)�����w�Ĺ������Լ������w�g϶�M(j��n)���w��,�������������wλ��Li+�Q����늽��|(zh��)���иߵ��x��늌�(d��o)��,���@��������⾧ʯ�Y(ji��)��(g��u)���u����̑B(t��i)늽��|(zh��)���x��늌�(d��o)�ʷdz��͵�ԭ��,��
��2��MԪ�ص��x�Ӄr(ji��)�B(t��i)�����r(ji��)��M=Sc��Y,��Er,��Al��Ga,��In��
��Li-M-X�wϵ��,��X����Cl-��Br-,��I-,��F-�������^С���x�Ӱ돽��133 pm�����Լ��^����ؓ(f��)��,����(du��)��x�ӕ�(hu��)�a(ch��n)���^������`��,�������x���w���܉�����������x���w��,����LiF-YF3���Ҝ��x��늌�(d��o)��ֻ��2��10-9 S cm-1,��LiF-ScF3���Ҝ��x��늌�(d��o)�ʃH��~10-6 S cm-1��
��Li-M-X��X=Cl-,��Br-,��I-���̑B(t��i)늽��|(zh��)�У���Ҫ�����N�Y(ji��)��(g��u)��
1��������ϵ�Y(ji��)��(g��u),�����gȺ��P-3m1,������Li3YCl6��Li3ErCl6��Li3ErI6,��
2��������ϵ�Y(ji��)��(g��u),�����gȺ��Pnma������Li3YbCl6,��
3����б��ϵ,�����gȺ��C2/m������Li3ScCl6,��Li3InCl6��Li3YBr6,��
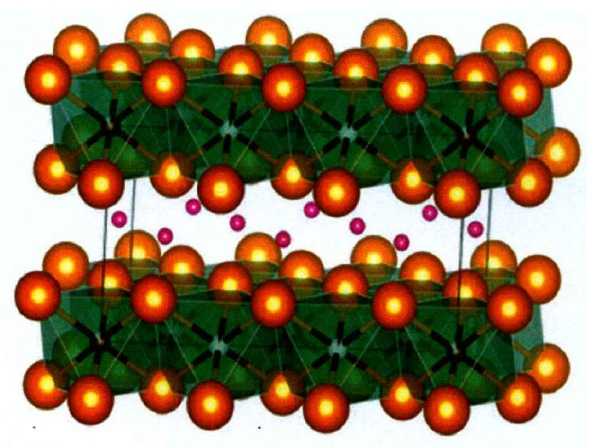
Li3lnCl6�̑B(t��i)늽��|(zh��)�Y(ji��)��(g��u)ʾ��D
3��MԪ�ص��x�Ӄr(ji��)�B(t��i)���ăr(ji��)��M=Zr��Hf��
���(l��i)���u����̑B(t��i)늽��|(zh��)Ŀǰ��ֹ��(b��o)�����^��,����2020��,��Nazar����ͨ�^(gu��)Zr4+ȡ��Y3+�õ�Li3-xY1-xZrxCl6������Nazar��ֻ�о���x=0.8,��
2021��,��Kwak�Ȍ�ȡ��������x=1�õ�Li2ZrCl6��ͨ�^(gu��)��(ji��n)�ΙC(j��)е��ĥ�õ���Li2ZrCl6�������Y(ji��)��(g��u),���x��늌�(d��o)�ʞ�4.0��10-4 S cm-1,������ĥ�õ��Ę�Ʒ��260�����˻��,���õ���Li2ZrCl6�ʆ�б�Y(ji��)��(g��u)���x��늌�(d��o)�ʴ���Ƚ�,��
Kwak���J(r��n)�������Y(ji��)��(g��u)�д��ڵ�M2-M3λ�c(di��n)�o(w��)�������x��늌�(d��o)���h(yu��n)���چ�б�Y(ji��)��(g��u)����Ҫ��(n��i)��֮һ,��Wang�����M(j��n)һ���о���Li2ZrCl6�ɷN�Y(ji��)��(g��u)�е��x��늌�(d��o)��������I�r(ji��)λ����Փ�о��˃ɷN�Y(ji��)��(g��u)�е��x���w��·�����w���܉�,��������Y(ji��)��(g��u)�е��w���܉��@��С�چ�б�Y(ji��)��(g��u),����������Y(ji��)��(g��u)��Li2ZrCl6���и��ߵ��x��늌�(d��o)�ʡ�
�u����̑B(t��i)늽��|(zh��)�����܃�(y��u)��(sh��)
���Ŀǰ�о��Ј�(b��o)����������̑B(t��i)늽��|(zh��),���u����늽��|(zh��)�ă�(y��u)��(sh��)��������A(y��)Ҋ(ji��n)�ăr(ji��)��(y��u)��(sh��)����O�ߵ�������(w��n)����,���̑B(t��i)�x�ӌ�(d��o)늄��У�����늽��|(zh��)������ߵ�늌�(d��o)��,����������Ҫԭ��Li2S�ăr(ji��)��r(ji��)���h(yu��n)����LiCl�ăr(ji��)��,�������u�����Ƃ��^(gu��)���в���(hu��)�a(ch��n)��H2S���ж����w������Ҫ��(y��n)��Ķ��Ԛ��,����Փ��ֻ��Ҫ��������ķՇ��¾Ͳ���(hu��)�и��a(ch��n)�������,��ˮϵ�ϳɲ���Ҳ�dz��m�乤�I(y��)��Ҏ(gu��)ģ�����a(ch��n)�h(hu��n)����
Ŀǰ�о����u��������ʹ���˴������F����ϡ��Ԫ��(In,��Sc,��Y��)����r(ji��)��Ԫ���S�ȶ�����Ƿȱ,��Ȼ��������u����늽��|(zh��)�о��ЏV��ʹ�õ�ZrԪ�ؾ��з��,����ڵăr(ji��)��(y��u)��(sh��)ǰ���������о��C��(sh��)��Fe3+���s��Li2ZrCl6ͬ�r(sh��)�߂�10−3 S��cm−1��(sh��)����(j��)��늌�(d��o)�ʺߵ�������(w��n)����,���c��Ԫ���OҲ��(sh��)�F(xi��n)���^��(w��n)����늳�ѭ�h(hu��n),��
���⣬�о����ձ�_�J(r��n)���C��(sh��)���u��������m��ƥ��߉����O�Č���(w��n)���Դ��ںͽ��������,������(du��)��ͬ�Ӿ������O��(w��n)���Ե�������늽��|(zh��),���u�����ּ�����^�õ����W(xu��)���ܡ��ձ��_(d��)��10-3 S��cm−1,��
�u����늽��|(zh��)�Ĺ��Ѓ�(y��u)��(sh��)���ڼ���˸�������(w��n)���Ժ͌�늻��W(xu��)���ڵ�ͬ�r(sh��)������x��늌�(d��o)��,�������������̑B(t��i)늳ؑ�(y��ng)���е�һ�(xi��ng)��Ҫ�����O���ƺ͑�(y��ng)�ò��ԡ�Ŀǰ�u����늽��|(zh��)���о��M(j��n)չ�^��,�����x��늌�(d��o)��,�����O���ϼ����ԡ��՚�/����h(hu��n)����(w��n)���ԵȆ�(w��n)�}߀�д��M(j��n)һ������,������ͳɱ����h(hu��n)���Ѻ�,���������늽��|(zh��)���и��郞(y��u)���ĸ�늉����O��(w��n)����,������(du��)�^�ߵ���x��늌�(d��o)�ʵ������m������һ�(xi��ng)��(d��)�ص����O��(c��)��늽��|(zh��)�����Ƅ�(d��ng)ȫ�̑B(t��i)늳�����?q��)��û��?br/>
�u����̑B(t��i)늽��|(zh��)�đ�(y��ng)���M(j��n)չ
�u����̑B(t��i)늽��|(zh��)���������O늉�����,�����ͽ����迹������늽��|(zh��)���������Ͼ��Ѓ�(y��u)��������,������ژ�(g��u)���������ܶȵ�ȫ�̑B(t��i)�늳��о�����Ҫ�đ�(y��ng)�Ãr(ji��)ֵ�͌�(sh��)��ǰ��,��
��ȫ�̑B(t��i)�늳ؽY(ji��)��(g��u)�M���У��u����̑B(t��i)늽��|(zh��)һ�����顰��x�����ӄ������뵽���O�����л�ֱ������늽��|(zh��)�Ӂ�(l��i)���^���O�����л������|(zh��)�c����(w��n)���̑B(t��i)늽��|(zh��)��֮�g�ĸ�����(y��ng),��
�u����늽��|(zh��)�����Ƿ�����늽��|(zh��)��������늉����ڼ���늉��L(zh��ng)ѭ�h(hu��n)��(w��n)�����Ͼ��Ѓ�(y��u)��(sh��),��
�u����늽��|(zh��)�c�����������Ԫ���O���Ͻ��|�r(sh��)���������õĻ��W(xu��)/늻��W(xu��)��(w��n)���ԣ�����늽��|(zh��)���������^����늻��W(xu��)����,���������顰��x�����ӄ������뵽���O��������,���u����늽��|(zh��)߀����ͨ�^(gu��)ALDԭ�ӳ��e������ذ��������O���Բ��ϱ��棬���_(d��)�����^�c����늽��|(zh��)�ĸ�����(y��ng)�Ķ���(sh��)�F(xi��n)��(w��n)�����O�Y(ji��)��(g��u)������,����LiAlF4������LiNi0.8Co0.1Mn0.1O2��,��
�u����̑B(t��i)늽��|(zh��)�ĺϳ�·��
�u����ĺϳ��Ǿ��w�Y(ji��)��(g��u)�ؽM�Ļ��W(xu��)����(y��ng)�^(gu��)�̣����ڌ�(sh��)�(y��n)�н����u��������Һ���܄��Y(ji��)�������ϟ��Y(ji��)�ȷ���,�������(l��i),���S��������ĥ�Y(ji��)�ϟ��Y(ji��)��ˇ�ڹ̑B(t��i)늽��|(zh��)�Ƃ��Б�(y��ng)�õ��d������늽��|(zh��),��������늽��|(zh��)���u����늽��|(zh��)�Ⱦ��в���ԓ�ϳɹ�ˇ�Ƃ�Ĉ�(b��o)��,�����u����늽��|(zh��)�Ƃ䷽�棬��Asano�ȳɹ��Ƃ���Ҝ�늌�(d��o)�ʵ�Li3YBr6�cLi3YCl6늽��|(zh��)�_(k��i)ʼ,����ĥ��ˇ�ɞ��о����u����늽��|(zh��)�ϳɵ�������ˇ,��
��(d��ng)ǰ���u����̑B(t��i)늽��|(zh��)�ĺϳ���Ҫ���ÙC(j��)е�����ĥ�ߜ�?z��)��Y(ji��)·��,�����������ĺϳɷ���,����Һ��ϳɡ�������e��,����(b��o)��������(du��)�^��,���ڌ�(sh��)�H�Ĺ̑B(t��i)늳ؑ�(y��ng)���У��u����늽��|(zh��)������,���^��ò�����W(xu��)���|(zh��)�Ȍ���(du��)�̑B(t��i)늳ص����ܮa(ch��n)�����Ӱ�,������о��u����늽��|(zh��)���P(gu��n)�ĺϳ�;���c�Ƃ乤ˇ��(du��)�䌍(sh��)�û��l(f��)չ������Ҫ���x��
�u����̑B(t��i)늽��|(zh��)�x��늌�(d��o)�ʵ�����
�M��2018��Asano���˺ϳɳ��Ҝ��x��늌�(d��o)�ʿ��_(d��)10-4 S cm-1���u����̑B(t��i)늽��|(zh��),����������(du��)������̑B(t��i)늽��|(zh��)���ЙC(j��)Һ�B(t��i)늽��|(zh��)10-2 S cm-1���x��늌�(d��o)��,������һ���IJ�࣬ؽ���˂�̽������(y��ng)�IJ���ȥ�Ƃ���и����x��늌�(d��o)�ʵ��u����̑B(t��i)늽��|(zh��),��
�u����̑B(t��i)늽��|(zh��)һ�������u����x�ӽM�ɽY(ji��)��(g��u)���,����x�Ӻͽ����(y��ng)�x��Mһ��λ�����u����x�ӽM�ɵİ����w���ģ������еĺ�䇰����w��,���λ��δ����ȫռ��(j��),�����в��֞��λ,���@Щ��λ���J(r��n)�����u����̑B(t��i)늽��|(zh��)����10-4 S cm-1����(j��)�Ҝ��x��늌�(d��o)�ʵ�ԭ��֮һ���@���о���̽����������u����̑B(t��i)늽��|(zh��)���x��늌�(d��o)���ṩ��˼·,�����s�������Ҋ(ji��n)���о��ֶ�֮һ,�����sԪ�ص��x�Ӱ돽���x�Ӄr(ji��)�B(t��i)Ӱ���늽��|(zh��)���ϵľ���(sh��)���x��늌�(d��o)�ʡ�
��1�����s���������u����̑B(t��i)늽��|(zh��)���x��늌�(d��o)��
��������̑B(t��i)늽��|(zh��)������̑B(t��i)늽��|(zh��)��,�����s���Ե��ֶηdz���Ҋ(ji��n),��ͨ�^(gu��)�ض�Ԫ�صē��s�����Ԍ�(du��)늽��|(zh��)ijһ�������|(zh��)�M(j��n)�и���,��Ҳ����ͬ�r(sh��)��(du��)ij�������|(zh��)ͬ�r(sh��)����,��
�����u����̑B(t��i)늽��|(zh��)�п�λ����Ҫ���ã�Nazar��ʹ�������}���Ƃ䷽����Li3YCl6�Г��sZr4+�õ�Li3-xY1-xZrxCl6,��Zr4+���s��Li3YCl6�Y(ji��)��(g��u)�������µĿ�λ,��ͬ�r(sh��)�S��Zr4+���s�������ӣ�Li3YCl6�ĽY(ji��)��(g��u)����������Y(ji��)��(g��u),��P-3m1����(j��ng)�v��������Y(ji��)��(g��u),��Pnma������������Y(ji��)��(g��u)��Pnma���D(zhu��n)׃,������е�YCl6�����w����(du��)�����l(f��)���˃Aб,���ҳ��F(xi��n)����Li+ռ��(j��)�����wλ��Li3-xY1-xZrxCl6��x=0.5�r(sh��)�����,���x��늌�(d��o)���_(d��)����ֵ1.4��10-3 S cm-1,����ܞ�0.33 eV��Nazar�Ȉ�(b��o)����Zr4+���s����(l��i)�о����x���sԪ���ṩ�˅���,��
��2���ϳɷ���Ӱ��u����̑B(t��i)늽��|(zh��)���x��늌�(d��o)��
2018��Asano�Ⱥϳ�Li3YCl6�r(sh��)�l(f��)�F(xi��n)�C(j��)е��ĥ�õ���늽��|(zh��)���x��늌�(d��o)�ʱ��˻�֮��ĸ�,��Li3YCl6��(j��ng)�^(gu��)�˻�Y(ji��)������ߕr(sh��)���x��늌�(d��o)�ʷ�������,��Schlem���M(j��n)һ��Ԕ��(x��)̽������ĥ���˻���Ƃ䷽����(du��)Li3MCl6��M=Y,��Er���ĽY(ji��)��(g��u)���x��늌�(d��o)���ܵ�Ӱ푣���Li3MCl6��M=Y,��Er���д���M2-M3λ�c(di��n)�o(w��)��,���@�Nλ�c(di��n)�o(w��)��̶�Խ�ߣ���(du��)��(y��ng)�x�ӂ�ݔͨ����ƿ�iԽ��,���x���w���܉�Խ��,��Խ�������x���w�ƣ��C(j��)е��ĥ�õ���Li3MCl6��M=Y,��Er���е�M2-M3�o(w��)��̶��^��,���˻�֮���@�N�o(w��)��̶Ƚ��ͣ�����˃ɷN�ϳɷ�����(du��)�x��늌�(d��o)�ʵ�Ӱ�,��
����,���½��о��C��(sh��)ˮ�܄��Ƃ��Li3InCl6���Ѓ�(y��u)�����x�ӌ�(d��o)����ܺ�늻��W(xu��)���ܣ������@�N�ϳ�·���Ƿ�������m��,���Ƿ��m�����нM�ɵ��u����̑B(t��i)늽��|(zh��)߀�д��M(j��n)һ�����(y��n)�C��
�u����늽��|(zh��)�c늘O���ϵļ�����
�����O���Բ��ϼ����Է���,����(d��ng)ǰ�u����늽��|(zh��)��������c��늉����O�����ڳ�Ҏ(gu��)늻��W(xu��)�����¹���,�����늽��|(zh��)�ĸ�늉���(w��n)���ԣ��U(ku��)������늉����ڌ�(du��)�ڸ�늉��������Ӡ����O�������ܵİl(f��)�]���P(gu��n)��Ҫ,�������u����늽��|(zh��)�ڸ�늉������µ�늻��W(xu��)���F(xi��n)�о��^��,��
��ؓ(f��)�O���ϼ����Է��棬䇽���ؓ(f��)�O�ĸ���Փ�������͵���늉�ʹ��ɞ�l(f��)�]ȫ�̑B(t��i)�늳ظ������ܶȵ��P(gu��n)�Iһ�h(hu��n),�����Ǯ�(d��ng)ǰ���u����늽��|(zh��)߀�o(w��)���ͼ���䇽���ؓ(f��)�O�����㟺Ͻ�ؓ(f��)�O�ȼ���,��
����F���s�Ȳ���ʹ늽��|(zh��)�c䇽����g�γɸ����ܵ����g�ӣ����H�ܸ������c䇽���ؓ(f��)�O�ļ�����߀�����늽��|(zh��)��늻��W(xu��)��(w��n)���Դ��ںͿ������Դ���,�����u����늽��|(zh��)�ķ�(w��n)����/�����Ը�������̽���Ե��о�,��Ȼ���u����늽��|(zh��)��ؓ(f��)�O����(w��n)�����������^(gu��)�ɽ����x�ӌ�(d��o)�µı���ȱ�ݣ������Ҫ�M�������(l��i)�ƶ�늽��|(zh��)�ӵIJ��ԁ�(l��i)�����u�����cؓ(f��)�O��ֱ�ӽ��|,��
�Y(ji��)
����һ�(l��i)���d�ğo(w��)�C(j��)�̑B(t��i)늽��|(zh��)����,���u����늽��|(zh��)���ڵ�һЩ��(w��n)�}������δ��(l��i)����õ����ƣ���Kʹ��ɞ�����ǰ���Ĺ̑B(t��i)늽��|(zh��)֮һ,��
�����Y�ϣ�
[1]ꐎ�,������(chu��ng)���x�ѵȣ��u����̑B(t��i)늽��|(zh��)�о��M(j��n)չ,���A�пƼ���W(xu��)
[2]���P�����ڵ��ĸ�������u�����ȫ�̑B(t��i)�늳�,���Ї�(gu��)�ƌW(xu��)���g(sh��)��W(xu��)
[3]�S�Ԃ����u����̑B(t��i)늽��|(zh��)�����܃�(y��u)���c��������о����A�пƼ���W(xu��)
���Ї�(gu��)���w�W(w��ng)������/ƽ����
ע���DƬ���̘I(y��)��;,�������֙�(qu��n)��֪?ji��ng)h��,��


















