中國粉體網(wǎng)訊
背景介紹
低溫嚴重損害了鋰離子電池的性能,因此鋰離子電池需要具有寬流動性范圍,、離子擴散速度快和脫溶劑化能較低的電解質,。而這里面的關鍵在于在Li+和溶劑分子之間建立溫和的內部相互作用,這在商業(yè)碳酸亞乙酯基電解質中很難實現(xiàn),。
正文部分
成果簡介
近日,,湖南大學劉繼磊教授,,構建了低介電常數(shù)(ε)溶劑主導配位的溶劑化結構,并通過羰基氧的電負性調節(jié)碳酸亞乙酯的配位強度,。改性電解質在−90 °C時表現(xiàn)出高離子電導率(1.46 mS·cm−1) ,,并在−110 °C時保持液態(tài)。因此,,4.5 V石墨基軟包電池在−10 °C的200次循環(huán)中達到約98%的容量 保持率,,沒有鋰枝晶。這些電池在−70 °C時也能保持約60%的室溫放電容量,,即使在約−100 °C的溫度下也能奇跡般地保持放電功能,。該研究以題目為“Breaking solvation dominance of ethylene carbonate via molecular charge engineering enables lower temperature battery”的論文發(fā)表在國際頂級期刊《Nature Communications》上。

圖文導讀
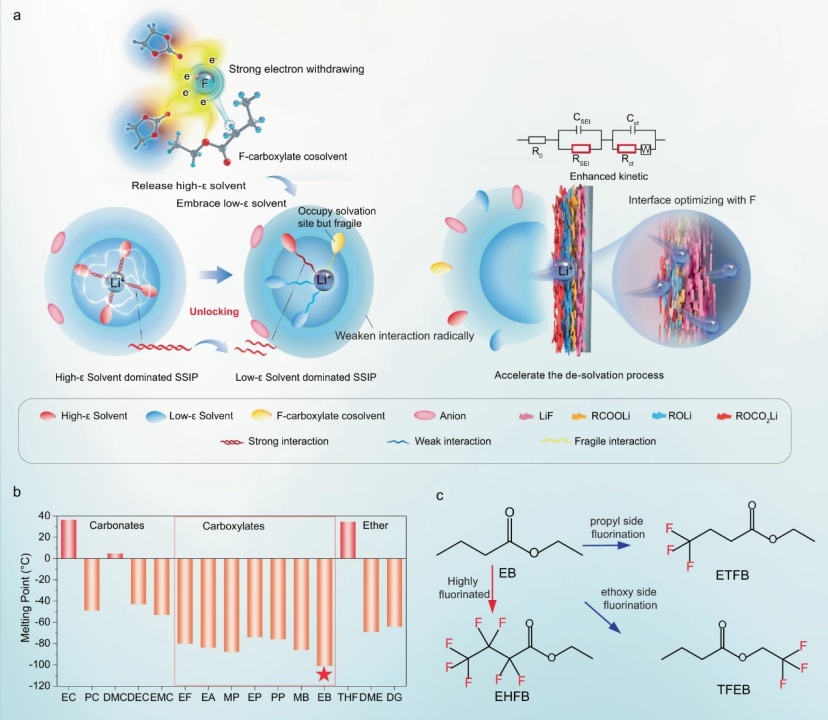
【圖1】a低溫電解質設計原則,。b常見碳酸鹽和羧酸鹽溶劑的熔點,。c所選EB及其氟化類似物共溶劑的化學結構。
在LIB電解質中,,Li+通常通過電負性羰基氧與碳酸鹽電解質中的極性溶劑分子配位,。理論上,在不犧牲極性溶劑的高ε性質的情況下削弱這種配位的一種方法是降低高ε溶劑中羰基氧的電負性,,而不是用低ε溶劑取代它,。這可能通過引入強吸電子元素來實現(xiàn),例如氟,。氟化預計會削弱高ε溶劑(即環(huán)狀碳酸酯)和Li+之間的配位相互作用(圖1a),,導致(i)釋放更多的高ε溶劑,這將促進低ε溶劑(如線性碳酸酯)與Li+的配位,,占據(jù)其配位位點,,從而將溶劑分離的離子對(SSIP)從高ε溶劑為主轉化為低ε溶劑為主,以及(ii)打破剩余配位的高ε溶劑的相互作用(圖1a),。獨特的溶劑化結構具有幾個優(yōu)點:(i)通過降低高ε溶劑的配位數(shù)和強度以及促進低ε溶劑主導的溶劑化結構的形成,,顯著而徹底地削弱了Li+和溶劑之間的整體配位相互作用(圖1a)。此外,,氟化羧酸鹽共溶劑也將通過羰基參與溶劑化,,即使其與Li+的相互作用減弱(圖1a)。所有這些變化一起促進了所需溶劑化結構的形成,,其中Li+和所有溶劑之間的相互作用弱得多,,這有望拓寬液體溫度范圍和進一步促進Li+脫溶劑化。(ii)由于較低的LUMO能量,,氟化共溶劑將有利于富F SEI的形成,。此外,氟化會降低電解質的HOMO能量,從而拓寬其在高壓電池中的電化學窗口,。這種方法提供了一種更有效的方法來恢復所需的溶劑化結構,,并有望將其應用擴展到極低的溫度�,;谶@些考慮,,本工作將丁酸乙酯(EB)確定為要氟化的溶劑,因為其熔點低(圖1b),。開發(fā)了一系列含有EB類似物作為共溶劑的高性能LIB電解質,,包括具有不同氟化程度或氟位點的4,4,4-三氟丁酸乙酯(ETFB)、七氟丁酸乙酯和2,2,2-三氟丁酸乙基酯(TFEB)(圖1c),。
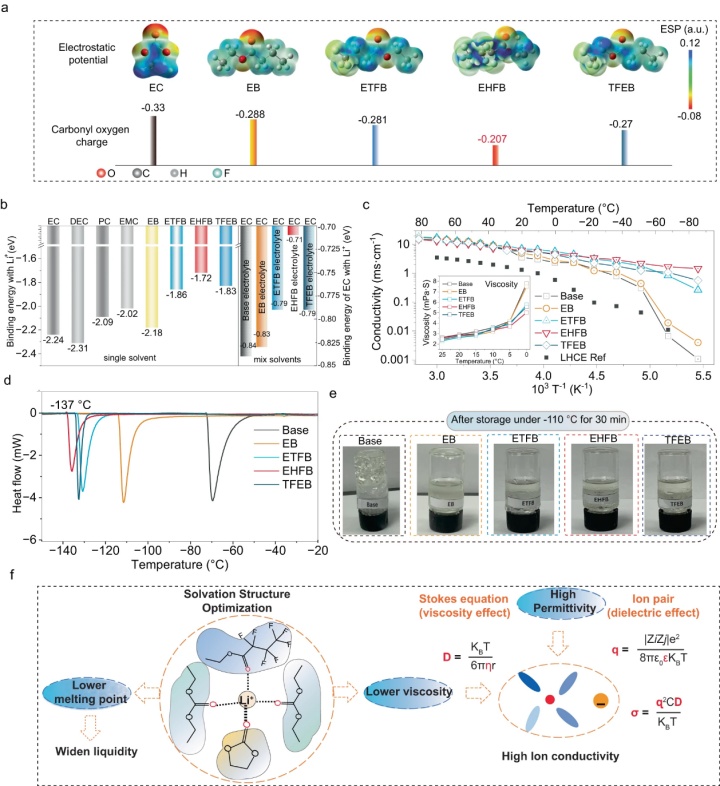
【圖2】a 靜電勢(ESP)圖顯示了本工作中考慮的溶劑分子電荷分布,。b Li+與不同溶劑的結合能。c基礎電解質和含有EB,、ETFB,、EHFB和TFEB的電解質電導率。d上述電解質的DSC曲線,。e不同電解質在−110 °C下儲存后的圖像,,持續(xù)30 min。f溶劑化結構與電解質物理性質的關系,。
氟化EB衍生物在羰基O原子周圍的電子密度低于EC或EB(圖2a),,導致與Li+的結合較弱(圖2b)。此外,,氟化程度影響助溶劑的電負性和Li+-溶劑配位強度(圖2b),。例如,EHFB-Li+在含氟共溶劑中具有最低的結合能(~1.72 eV),,并且在混合溶劑中EHFB系統(tǒng)的EC-Li+具有最低的結合能(0.71 eV)。這些結果表明,,氟化不僅降低了丁酸乙酯本身的配位,,而且削弱了周圍EC和Li+之間的相互作用,后者可以用“偶極-偶極效應”來解釋,。具體地說,,氟的強電子親和力導致電荷分布從C=O端偏移到-CF3端,這改變了氟化丁酸乙酯和周圍EC分子之間的偶極-偶極相互作用,,最終導致EC對Li+的弱溶劑化,。
弱溶劑化結構顯著改善了電解質的物理性質(圖2f),如離子電導率和流動性,。這是因為(i)一些EC分子從溶劑化結構中釋放,,以及(ii)更多低熔點的DEC和共溶劑參與溶劑化結構,導致較低的熔點(圖2d)和較低的體相電解質粘度(圖2c插圖)。具體而言,,估計冰點增加的順序為EHFB(−135 °C),,TFEB(−132 °C)和ETFB(−130 °C)(圖2d),遵循與EC-Li+結合能相同的趨勢,。EHFB電解質即使在−110 °C下儲存30分鐘依然能保持液態(tài)(圖2e),。基于粘度效應和介電效應(圖2f),,高離子電導率取決于的高介電常數(shù)和低粘度,,因此具有高介電常數(shù)和低粘度的EHFB電解質在−90 °C下實現(xiàn)了約1.46 mS·cm−1的高離子電導率 (圖2c)。相反,,基礎電解質在約−50 °C時凍結(圖2d),,當溫度降至−90 °C時,顯示出較差的離子導電性(0.001 mS·cm−1)(圖2c),。
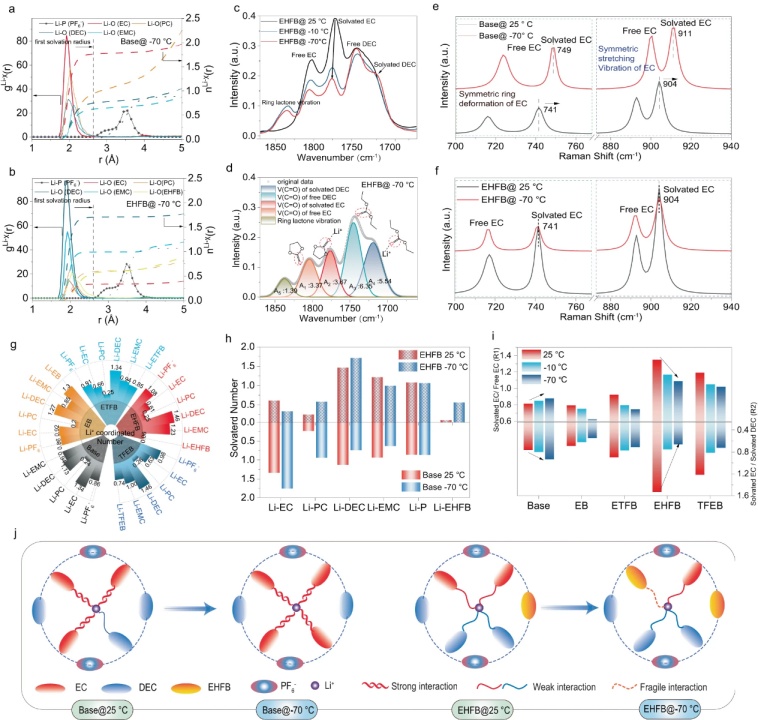
【圖3】基于分子動力學(MD)模擬計算出−70°C下基礎電解質(a)和EHFB電解質(b)的徑向分布函數(shù)(g(r))和配位數(shù)(n(r),。c 在EHFB電解質中不同溫度下EC和DEC的FTIR光譜C=O峰區(qū)域。d用Voigt函數(shù)擬合−70 °C下EHFB電解質的FTIR光譜,�,;A電解質(e)和EHFB電解質(f)中EC的對稱環(huán)變形和(C–O)鍵的拉伸振動拉曼光譜。g基于計算的RDF,,五種電解質在25 °C時的配位數(shù),。h 25 °C和−70 °C下基礎電解質和EHFB電解質中所有溶劑組分與Li+的配位數(shù)。i在不同溫度下,,基礎電解質和EHFB電解質中的溶劑化EC與游離EC以及溶劑化EC與溶劑化DEC的比值,。J當溫度從25°C降低至−70 °C時,基礎電解質和EHFB電解質中溶劑化結構變化示意圖 ,。
通過分子動力學(MD)模擬將溶劑化結構解耦,,并提供了在每種電解質情況下計算的Li+的徑向分布函數(shù)(RDF)(g(r))和配位數(shù)(n(r))(圖3a、b),。每種溶劑的第一溶劑化半徑為~2.65 Å,,PF6−占據(jù)第二個溶劑化殼層(~4.2 Å)形成分離的離子對(SIP-PF6−)。在基礎電解質中,,EC是第一Li+溶劑化殼中的主溶劑,,室溫下的配位數(shù)為1.31,然后是線性碳酸鹽DEC(1.13)和EMC(0.94)(圖3g),。然而,,隨著上述共溶劑的加入,Li+溶劑化結構發(fā)生了顯著變化,。具體而言,,EHFB電解質中的EC配位數(shù)急劇下降至0.61(圖3b和圖3g),而DEC配位數(shù)上升至1.46(圖3b和圖3g)。在EB,、ETFB和TFEB系統(tǒng)中觀察到類似的趨勢,,表明從EC主導的溶劑化結構轉變?yōu)镈EC主導的溶劑化結構。這些轉變與氟化相關,,并且共溶劑的氟化度越高,,DEC溶劑與Li+的配位就越強,EC與Li+之間的相互作用就越弱,。這些影響在較低的溫度下更為明顯,。例如,EHFB電解質中的DEC配位數(shù)從25°C時的1.46增加至−70 °C時的1.71,,而EC配位數(shù)從0.61下降到0.33(圖3h),,表明在LT的第一個溶劑化殼中,更多的EC被DEC取代,。相反,,在基礎電解質中,隨著溫度的降低,,EC與Li+的配位數(shù)增加(從25°C時的1.34增加到-70°C時的1.76),,而DEC配位數(shù)減少(從25°C時的1.13減少到-70°C時的0.74)�,?紤]到配位每個Li+的溶劑分子總數(shù)恒定,,EC配位的減少不可避免地導致DEC配位的增加。顯然,,減少EC配位的優(yōu)勢不會被DEC配位的增加所掩蓋,,這歸因于DEC相對于EC固有的低極性性質。一方面,,由于EC是一種高極性溶劑,,因此EC配位數(shù)的減少無疑會導致溶劑化的減弱。另一方面,,DEC的配位數(shù)的增加也導致溶劑化的減弱,,因為其極性較低。因此,,這兩個因素協(xié)同促進了整體弱化溶劑化結構的形成。這突出了EHFB共溶劑在LT應用中的優(yōu)點,。除了氟化共溶劑對主要溶劑溶劑化的影響外,,它們還影響Li+溶劑化,因為EB,、ETFB,、TFEB和EHFB的配位數(shù)隨著氟化的增加從1.3、0.85、0.74降至0.06(圖3g),。這與計算的Li+與溶劑結合能十分一致(圖2b),。此外,EHFB的配位數(shù)從25 °C時的0.06急劇增加到−70 °C時的0.56(圖3h),。這表明EHFB在LT下對Li+的溶劑化更具活性,。低ε溶劑與共溶劑一起主導了溶劑化結構,導致Li+與內溶劑化鞘中所有溶劑之間的相互作用減弱(圖3j),。這些特征促進了Li+的脫溶劑化,,從而增強了LT下的電化學動力學。
溫度相關的FTIR和拉曼光譜分析進一步證實了共溶劑與主溶劑一起對Li+溶劑化的貢獻(圖3c-f),。游離和溶劑化C=O的IR峰(在1660-1870 cm−1的區(qū)域內)用Voigt函數(shù)擬合(圖3d),。溶劑化EC與游離EC之比(R1)和溶劑化EC與溶劑化DEC之比(R2)(等式1和等式2)用于量化溶劑化EC的相對豐度以及EC和DEC之間的配位競爭。
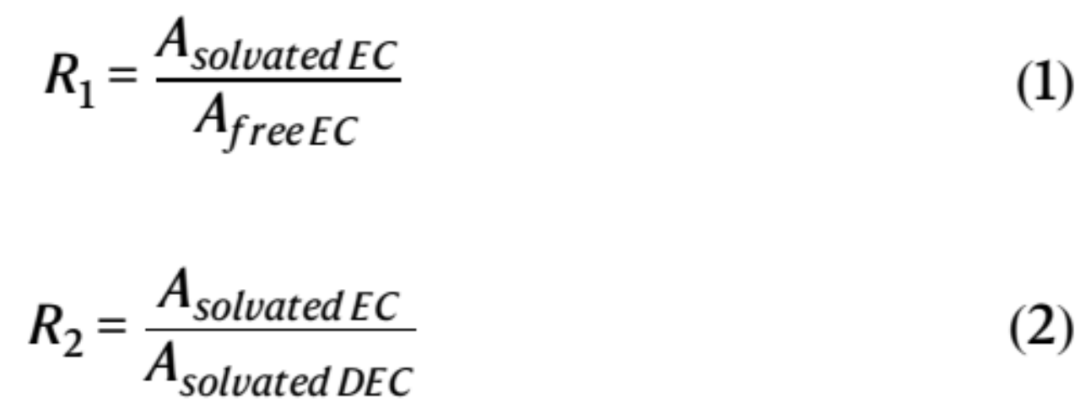
其中Asolvated EC,、Afree EC和Asolvate DEC是溶劑化EC,、游離EC和溶劑化DEC的C=O基團對應的振動峰積分面積強度(圖3d)。定量分析顯示,,隨著溫度從25℃下降至−70 °C,,R1和R2值都有所下降(圖3i)。例如,,EHFB電解質的R1值從1.34(25 °C)下降至1.09(−70 °C),,同時R2從1.53(25 °C)下降至0.66(−70 °C)(圖3i)。這表明,,共溶劑促進了DEC和Li+之間的配位,,同時EC和Li+間的相互作用減弱,尤其是在LT,。注意,,與ETFB和TFEB相比,EHFB電解質的R2值下降得更快(圖3i),,表明其在LT下對DEC主導的溶劑化結構有更大的選擇性,。相反,對于基礎電解質,,R1和R2都隨著溫度從25 °C降低至−70 °C而增加,,證實了在寬溫范圍內EC主導的溶劑化作用(圖3i)。此外,,這種變化伴隨著拉曼光譜中兩個溶劑化EC峰的顯著藍移(從741到749 cm−1,,從904到911 cm−1)(圖3e),進一步表明在LT基礎電解質中,,Li+和EC之間的配位相互作用更強,。這降低了其在寒冷條件下的實用性,。這些特征,包括降低的R1和R2值(圖3i)和抑制的C-O峰藍移(圖3f),,證明共溶劑能夠減弱EC的配位強度,,從而設計了以DEC為主溶劑,共溶劑參與的溶劑化結構,,最終形成了弱溶劑化結構(圖3j),。
【圖4】a不同電解質中的Li+溶劑化/脫溶劑化能。b氟化共溶劑在削弱Li+和溶劑分子之間的相互作用,、加速脫溶劑化和促進Li+擴散方面的關鍵作用,。根據(jù)采用基礎電解質(c)和EHFB電解質(d)的LCO/Gr軟包電池EIS數(shù)據(jù)得出的弛豫時間分布(DRT)的溫度依賴性圖。通過Arrhenius擬合Rct(e)和RSEI(f)得到相應的活化能,。−10 °C下,,采用基礎電解質(g)和EHFB電解質(h)的石墨/Li半電池兩個循環(huán)的原位DRT數(shù)據(jù)。
DFT計算表明,,氟化共溶劑顯著降低了EC/DEC電解質的Li+脫溶劑化能(圖4a),,并且這一趨勢高度依賴于氟化。共溶劑的氟化程度越高,,脫溶劑化能越小(從4EC的1.1 eV至EC-2DEC-EB的1.0 eV,,EC-2DEC-ETFB的0.93 eV和EC-2DEC-EHFB的0.83 eV)。這是由于氟取代基的強吸電子效應,,增強了Li+和低ε溶劑之間的配位,,并形成了DEC主導的、總體減弱的溶劑化結構,,從而促進了脫溶劑化過程(圖4b),。
通過對弛豫時間(DRT)分布分析進一步驗證了氟化共溶劑對Li+脫溶劑化的影響(圖4c,d),。該分析通過連續(xù)分布函數(shù)中的局部最大值對不同的電化學過程進行了分類,。Rct和RSEI都表現(xiàn)出強烈的溫度依賴性。低溫時Rct占主導地位,,高溫時RSEI占主導地位,。具體而言,EHFB電解質在−60°C時具有1.0 Ω的最低Rct(圖4d),,然后是TFEB(3.2Ω)和ETFB(4.7Ω),。這些值遠小于基礎電解質(8.8Ω)(圖4c),表明助溶劑在促進電荷轉移中的重要作用,。電荷轉移的活化能較低也證實了這一點(圖4f),,并且具有EHFB電解質的LCO/Gr軟包電池活化能估計為10.9 kJ·mol−1,約為基礎電解質的三分之一(30.4 kJ·mol−1),�,;罨馨碋HFB<TFEB< ETFB的順序增加,與脫溶劑化能的趨勢非常一致(圖4a),。采用基礎電解質和EHFB電解質的Gr/Li半電池在−10°C下兩次電化學循環(huán)的DRT圖譜(圖4g,,h)表明,EHFB系統(tǒng)表現(xiàn)出比基礎電解質小得多的Rct,,證實了共溶劑的引入促進了電荷轉移,,特別是在低溫運行的石墨負極中。此外,,與基礎電解質(29.3 kJ·mol−1)(圖4e)相比,,具有EHFB的全電池中Li+通過SEI的活化能低得多(19.8 kJ·mol−1)(圖4f),因此RSEI顯著降低(圖4g,,h),。此外,與基礎電解質不同(圖4g),,EHFB系統(tǒng)中的RSEI略有變化,,其值要小得多(圖4h),這表明源自EHFB的SEI具有高導電性,,并且比基礎電解質中的SEI更堅固,。
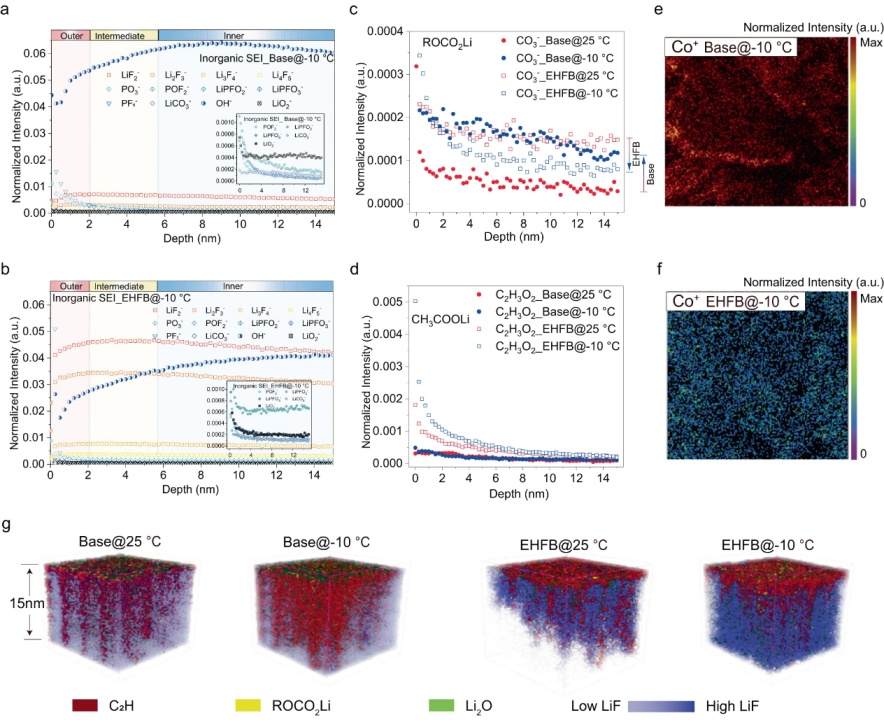
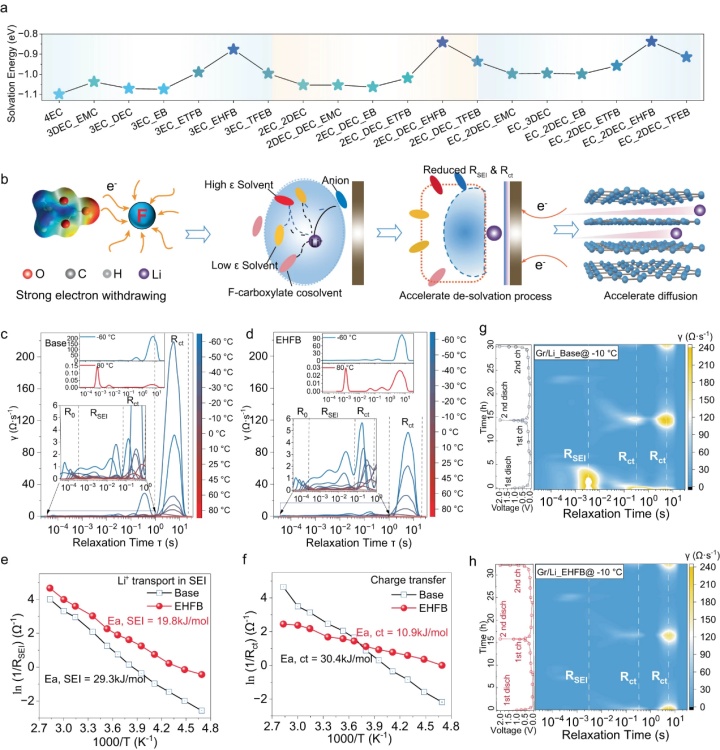
【圖5】在基礎電解質(a)和EHFB電解質(b)中,−10°C下長循環(huán)后無機SEI中官能團的深度分布,。25 °C和−10 °C時基礎電解質和EHFB電解質形成的SEI中ROCO2Li組分(c)和CH3COOLi組分的深度分布 ,。采用基礎電解質(e)和EHFB電解質(f)的石墨負極上Co+的空間分布。g在25°C和-10°C下,,采用基礎電解質和EHFB電解質的電池化成后石墨負極SEI最上面15nm的三維重建圖,。
用飛行時間二次離子質譜法(TOF-SIMS)表征了循環(huán)石墨電極上SEI層的成分/結構演變。深度剖面TOF-SIMS數(shù)據(jù)顯示,,有機部分(CH2−,、CO3−、C2H3O−和C2H3O2−)主要集中在SEI的外表面(圖5c,、d),,而無機LiF物種(LiF2−、Li2F3−,、Li3F4−,、Li4F5−)和OH−在SEI內側更普遍(圖5a、b),。離子碎片潛在來源包括三種主要有機成分:ROCO2Li(CO3−碎片),、CH3COLi(C2H3O−)和CH3COOLi(C2H3O2−),它們分別通過EC,、DEC和羧酸鹽的電化學還原產(chǎn)生,。在基礎電解質中,,ROCO2Li信號隨著溫度從25 °C降低至−10 °C而增強(圖5c),而CH3COLi信號減少,,并且?guī)缀鯖]有檢測到CH3COOLi信號(圖5d),。這表明在基礎電解質中EC是LT下進行還原的主要溶劑,而不是DEC,。相反,,−10 °C下,當使用EHFB電解質時,,ROCO2Li信號降低,,CH3COLi信號增加(圖5c),表明在EHFB中,,LT增強了DEC還原并抑制了EC還原,。在基礎電解質中,EC對Li+的溶劑化在LT時得到促進,,但在EHFB情況下得到緩解,。此外,檢測到的CH3COOLi信號表明,,EHFB共溶劑參與LT時石墨表面的成膜(圖5d),。此外,在源自EHFB電解質的界面中檢測到更多的LiF物種(圖5a,,b),,并且它們的量隨著溫度的降低而增加。SEI性質的差異反映在不同溫度下有機SEI組分(C2H,,ROCO2Li)和無機物種(LiF,,Li2O)的3D空間分布覆蓋圖中(圖5g)。具體而言,,在EHFB中,,僅在SEI的最外層中發(fā)現(xiàn)少量有機組分(即C2H),并且LT下更多的LiF存在于SEI內層中,。這可能是由于更多的EHFB參與溶劑化并有助于LT時SEI的形成,。相反,基礎電解質衍生的SEI中LiF少得多(圖5a,,圖5d),。此外,在EHFB電解質中,,RT和LT條件下Co+的溶解和串擾被有效抑制(圖5e,、f)。這可能是由于氟化電解質的抗氧化性,,用它可以很好地保護正極結構在約4.5 V的高電壓下不受損壞,。這突出了氟化共溶劑在高壓應用中的顯著優(yōu)勢和SEI的優(yōu)異性能,。相反,在基礎電解質中,,大量的Co+被溶解,,然后串擾到石墨負極,這對SEI具有高度破壞性(圖5e,、f)。
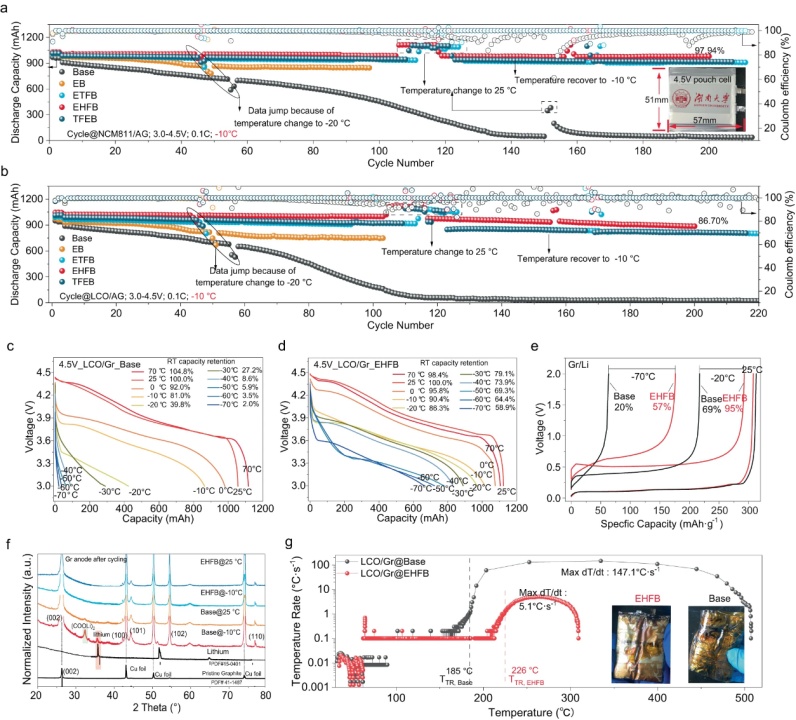
【圖6】NCM811/Gr(a)和LCO/Gr(b)電池在−10°C下不同電解質中的循環(huán)行為,。具有基礎電解質(c)和EHFB電解質(d)的LCO/Gr軟包電池RT充電-LT放電的電壓曲線,。e具有不同電解質的Gr/Li電池在不同溫度下的充電電壓曲線。f在−10°C和25 °C下長循環(huán)后石墨的XRD圖譜,。g完全充電LCO/Gr電池的溫升速率隨溫度的變化,。插圖顯示了測試后的照片。
將EHFB電解質與商業(yè)1Ah NCM811/Gr和LCO/Gr軟包電池匹配獲得了優(yōu)異的低溫電化學性能,。在−10 °C下200次循環(huán)后,,NCM811/Gr的容量保持率為97.94%,LCO/Gr的容量保持率為86.70%(圖6a,,b),。利用RT充電-LT放電方案,使用EHFB電解質的LCO/Gr軟包電池在−40 °C時保持830 mAh的高容量 ,,相當于其RT容量的73.9%,。即使在−70°C時,這些電池仍保留了約60%的RT容量(圖6d),。相反,,使用基礎電解質的LCO/Gr和NCM811/Gr電池表現(xiàn)出較差的性能,在−10 °C時僅保留約80%的RT容量 ,,在−40 °C時完全失效 (圖6c),。電池的低溫性能受到石墨負極的限制,這是由鋰枝晶引起的,。事實證明,,當在−10 °C下循環(huán)時,石墨負極基電池表現(xiàn)出顯著的容量衰減 (圖6a,,b),。因此,對Gr/Li電池在低溫下的性能進行了評估,。采用EHFB電解液的Gr/Li電池在-70°C和-20°C下充電,,室溫放電后分別保持了57%和95%的容量。這些值遠高于基礎電解質的值(分別為20%和69%的RT容量,,圖6e),。XRD分析顯示,,在−10°C循環(huán)的石墨負極中,在35.8°處觀察到明顯的鋰峰(圖6f),,而在EHFB情況下不存在,。這些發(fā)現(xiàn)都證實了改性電池在低溫下能有效抑制鋰枝晶的形成。使用加速量熱法(ARC)評估安全性能(圖6g),。結果表明,,與基礎電解質相比,使用EHFB電解質的LCO/Gr軟包電池安全性顯著提高,。EHFB電解質導致最大dT/dt顯著降低,,僅為5.1 °C s−1和高得多的熱失控溫度(TTR,226 °C),,能夠有效避免熱失控事件,。此外,最高溫度降至309 °C,,表明熱失控過程中釋放的總能量大幅減少,。
總結和展望
本工作展示了一種使用傳統(tǒng)EC基電解質的溶劑化設計策略,以提高LIBs低溫性能,。通過引入氟化共溶劑,,削弱了EC與Li+的強配位,并將EC主導的溶劑化結構轉變?yōu)镈EC主導的溶劑化結構,,特別是在低溫下,。這種設計促進了Li+的脫溶劑化,同時保持了EC的高介電性能,。此外,,氟化共溶劑也有助于形成富氟SEI,增強了石墨負極在寒冷條件下的穩(wěn)定性,。因此,,在低溫性能方面取得了顯著的改進,例如更寬的流動性范圍(將液體保持在−110 °C),,電導率更高(在−90 °C時為1.46 mS·cm−1 ),,更容易的脫溶劑化過程,并抑制了鋰枝晶的生長,。這使得1 Ah 4.5 V石墨基軟包電池在−10 °C下穩(wěn)定循環(huán)200多次,,當在−60 °C下充放電一圈時,只有2%的容量損失并保持334 mAh的容量,。此外,,電池在−70°C時放電 ,仍有60%的室溫容量,并能夠在約−100 °C的極低溫度下為設備供電 ,。這項工作為開發(fā)適用于極端環(huán)境的鋰離子電池提供了一種獨特的方法,。
參考文獻
Yuqing Chen, Qiu He, Yun Zhao, Wang Zhou, Peitao Xiao, Peng Gao, Naser Tavajohi, Jian Tu, Baohua Li, Xiangming He, Lidan Xing, Xiulin Fan & Jilei Liu*. Breaking solvation dominance of ethylene carbonate via molecular charge engineering enables lower temperature battery, Nature Communications.
DOI:10.1038/s41467-023-43163-9
https://doi.org/10.1038/s41467-023-43163-9
(中國粉體網(wǎng)編輯整理/喬木)
注:圖片非商業(yè)用途,存在侵權告知刪除,!