���Y����Ŀǰȫ����Ҫ����ԭ��֮һ���S���{���g(sh��)���w�ٰl(f��)չ,����������{�ײ����鰩�Y���ί��ṩ���µ�˼·�ͷ���,������(du��)���y(t��ng)�{�ײ��ϣ����������������t(y��)�W(xu��)�I(l��ng)��đ�(y��ng)�Ý����У�ˎ���d�w,����ᯟ�������(d��ng)�������²��Ϻ��[���Ĺ������,����Щ���(l��i)���҇�(gu��)�����ˆT����l(f��)��,����m(x��)�l(f��)�F(xi��n)�˺����ί����Y�Ķ�N��ʽ,��һЩ���гɹ��ѽ�(j��ng)��Ո(q��ng)���P(gu��n)����������һ���R����(sh��)�`�ṩ����Փ����,��

����
��ʽһ����������D(zhu��n)�Q���� ���ڌ�(sh��)�F(xi��n)��Ч��ȫ���[������ί�
�Ї�(gu��)�ƌW(xu��)Ժ�������M(j��n)���g(sh��)�о�Ժ�о��T���W(xu��)�h�c���ڴ�W(xu��)���ڏ���,����۳��д�W(xu��)�����섦�����о��F(tu��n)�(du��)�������黯�܄��]�l(f��)�����Ƃ���һ�N�߷��Ӿۺ���(PLGA)�������������c(di��n)(BPQDs)�ĺ˚��Y(ji��)��(g��u)�{����(BPQDs/PLGA),��PLGA����һ�N�ɽ������ˮ�������t(y��)�ø߷���,�����γɵľۺ�����܌���(n��i)���ĺ��������c(di��n)�c�����h(hu��n)�����^�_(k��i),�����C�˺��������c(di��n)���ί��^(gu��)���е����ܷ�(w��n)��,������ί��Y(ji��)�����������c(di��n)�֕�(hu��)�S��PLGA���ӵ�����õ�����ጷźͽ���,���M(j��n)����ȫ�ش��x���w��,��
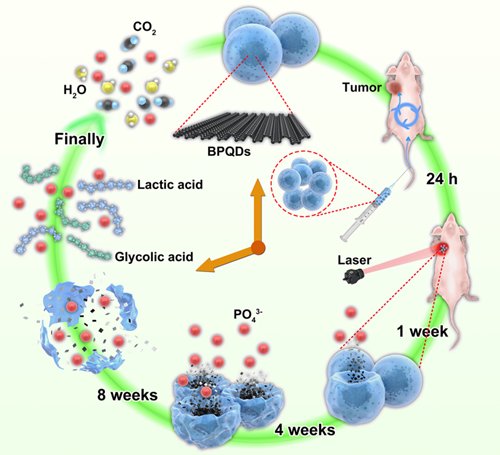
BPQDs/PLGA�w��(n��i)�ί��������^(gu��)��ʾ��D
��(x��)������(d��ng)�(sh��)�(y��n)��������BPQDs/PLGA���кܺõ����ﰲȫ�Ժ��[������(d��ng)������,����չ�F(xi��n)���ܸߵĹ���ί�Ч��,����(sh��)ʩ���犵Ľ��t����գ�������Ч�ؚ����[��,���@�N��������ɽ������D(zhu��n)�Q���ϵijɹ��аl(f��),���o(w��)�ɿ��Ƅ�(d��ng)����ί����g(sh��)�Č�(sh��)�H�R����(y��ng)��,��������{�ײ��ϵ������t(y��)�W(xu��)��(y��ng)���ṩָ��(d��o)�ͽ��b���о��F(tu��n)�(du��)����Ո(q��ng)�����P(gu��n)�l(f��)������,�����e�O�Ƅ�(d��ng)���(b��o)���P(gu��n)�R����(y��ng)���S��,����(zh��ng)ȡ���Ռ��������R����
��ʽ�������{�ױ�Ƭ�Ɍ�(sh��)�F(xi��n)�[���Ĺ���ί�,������������푑�(y��ng)�����f(xi��)ͬ�ί�
���A��W(xu��)������÷��,�����ڴ�W(xu��)���ڏ����Լ������W(xu��)����ʩ�M(j��n)܊����ʿ�Ղ��Ȍ��ҽM�ɵ��о��F(tu��n)�(du��)���Ã�(y��u)����Һ�B(t��i)���x��,���״Ό������S�{�ױ�Ƭ��(y��ng)�����\���ί��Ƅ��d�w���Ƃ��Լ����ܻ����,���аl(f��)��һ�Nؓ(f��)�d����ˎ�ﰢù�صġ����{��Ƭ�d�wϵ�y(t��ng)�������{�ױ�Ƭ���[����(x��)���zȡ����Ҫͨ�^(gu��)���ް�����ڃ�(n��i)���w����ø�w���͡��ݸC���錧(d��o)�Ĕzȡͨ·���M(j��n)�м�(x��)����(n��i)���(d��ng),�����S���{�ױ�Ƭ�^��ıȱ���e�܉�?y��n)黯��ˎ����ӵĴ��������춨���A(ch��),������dˎ���������{�ױ�Ƭ��(du��)�ڰ�ù�ص�ؓ(f��)�d���@�����ڂ��y(t��ng)�ľۺ���{�������d�w,������˻���ˎ�ﯟЧ,�����[�{�ױ�Ƭ��808nm�����������܉�a(ch��n)���ֲ��ߟᣬһ������������[���Ĺ���ί�,����һ����Ҳ�܉��(q��)��(d��ng)ˎ���ጷ�,��
�о������������dˎ�{�ױ�Ƭ�������w��(n��i)�İ�ȫ�Ժ�����Ч���^�����@,��ԇ�(y��n)�(y��n)�C�˺����dˎ�{�ױ�Ƭ�߂�ܺõ�����������,���о��в��õ�����푑�(y��ng)�{(di��o)��(ji��)�Ļ���������ί�(li��n)���ί��������@Щ��ģʽ�ɾ���(zh��n)�ί����Y,��Ŀǰ,��ԓ�о��ڄ�(d��ng)�(sh��)�(y��n)��ȡ��ͻ�ƣ���������ȱ�ݵ���������ȡ���ˏ�(qi��ng)��������Ч��,��
��ʽ����ͨ�^(gu��)���{��Ƭ����ù�صĻ���,�����Ĺ����(d��ng)��������Ч�Y(ji��)������(l��i)
���ϴ�W(xu��)��������ڈF(tu��n)�(du��)�c������W(xu��)����܊���ں��������ú��{��Ƭ�Ķ��ް��Y(ji��)��(g��u)�Լ�����ؓ(f��)늺�,����(sh��)�F(xi��n)�ˌ�(du��)���[��ˎ�ﰢù�صĸ�Чؓ(f��)�d,����ؓ(f��)�d�����_(d��)950%���h(yu��n)�h(yu��n)����Ŀǰ�ּ{��ˎ���d�w��ؓ(f��)�d��,���e���ڽ��t�������,�����{��Ƭ����Ч�Įa(ch��n)�����ͻ����������һ������Լӿ찢ù�ص�ጷ�,�������Ӽ�(x��)��Ĥ��ͨ�^(gu��)�Ժ͌�(du��)ˎ��Ĕzȡ,����һ�������ֱ�ӌ�(du��)�[����(x��)���a(ch��n)���������á�
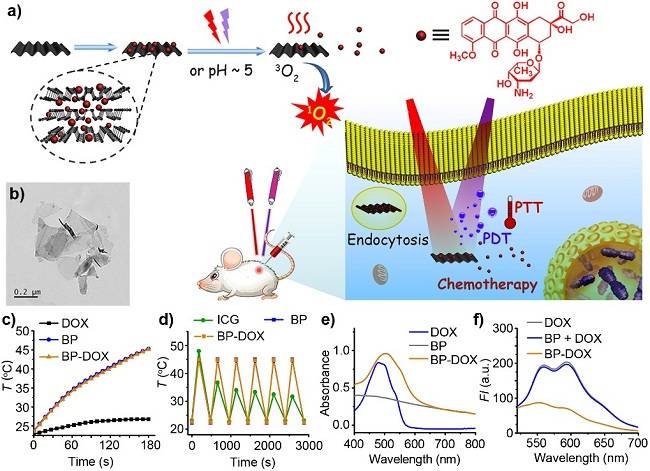
���{��Ƭ�����[��(li��n)���ί����O(sh��)Ӌ(j��)������
��a�����{��Ƭ���Ը�Чؓ(f��)�d��ù�أ���(j��ng)��(x��)����(n��i)���M(j��n)���[����(x��)��,�������¿����l(f��)ˎ��Ŀ���ጷ�,��ͬ�r(sh��)�Y(ji��)�Ϻ��Ĺ����(d��ng)�����ԣ���(sh��)�F(xi��n)���Nģʽ(li��n)�Ϛ����[����(x��)��,��
��b�����{��Ƭ��TEM�D
��c-d�����{��Ƭ�����ù�����Լ���᷀(w��n)����
��e-f������-��Ҋ(ji��n)���չ��V�͟ɹ���V׃���C����ù���c���{��Ƭ֮�g���������
�w����w��(n��i)��(sh��)�(y��n)�Y(ji��)������,��ͨ�^(gu��)���{��Ƭ���Ɍ���ù�صĻ���,�����Ĺ����(d��ng)��������Ч�Y(ji��)������(l��i),����(sh��)�F(xi��n)���N�ί�ģʽ��(li��n)�ϣ���Ч�����[��,������,���������w��(n��i)����u�ֽ�錦(du��)�����w�o(w��)����������x�ӣ�Ѫ��Ҏ(gu��)�����Լ���,���I���ܙz�y(c��)�Y(ji��)������,��ע����Ĵ�����(xi��ng)����ָ��(bi��o)���������,�����{��ˎ���\(y��n)ݔ�wϵ�錍(sh��)�F(xi��n)��(du��)�[���İ�ȫ,����Ч(li��n)���ί��ṩ��һ��(g��)���µ�ƽ�_(t��i)��
��ʽ�ģ����t���푑�(y��ng)�ĺ���ˮ���z���� ���ڿ���ˎ���ؓ(f��)�d�Ϳɿ�ጷ�
���ڴ�W(xu��)���ϣ�Han Zhang�����ڈF(tu��n)�(du��)(li��n)�������������t(y��)Ժ�U��퍣�Shiyun Bao����ʿ,����俨����˹���t(y��)�W(xu��)Ժ���x����Yihai Cao�����ڈF(tu��n)�(du��)���÷ǽ��|ʽ̽�^��Һ�B(t��i)���x����,���ɹ��Ƃ��˸��|(zh��)�����S�Ӡ���ϩ�{��Ƭ�����c����ˎ��һ�ɵ�����ɽ������ˮ���z������,���Ƃ�����ܺ���ˮ���z����,��ԓ���Ͽ���ͨ�^(gu��)�o(w��)��(chu��ng)��ʽע�䵽�w��(n��i)�[���M�����ڽ��t����������,�����σ�(n��i)�ĺ����܉�a(ch��n)���ֲ��ߟ�,���@Щ����һ������������[���Ĺ���ί�����һ����Ҳ�܉��(q��)��(d��ng)ˎ���ጷ�,��ጷ�ˎ������ʿ���ͨ�^(gu��)����Ĺ��(ch��ng)��(qi��ng)��,������r(sh��)�g�����ם�ȵȶ�N����(sh��)�M(j��n)���Ԅ�(d��ng),���ɿصؾ��_�{(di��o)��,����K�_(d��)���ί��[����Ч����
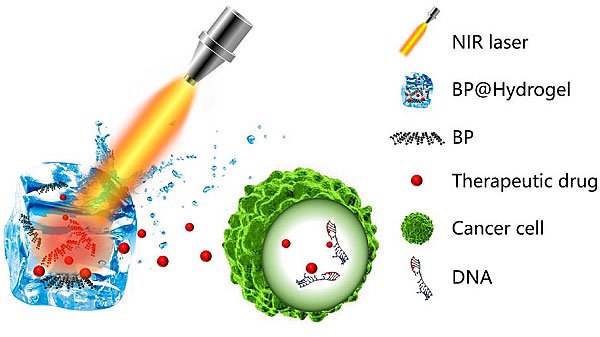
���ܺ���ˮ���z����ԭ��ʾ��D,��
�g(sh��)��ԓ�����Ԅ�(d��ng)�������Ȼ�o(w��)���a(ch��n)��,�����ԘO��ظ��ƻ��ߵ������|(zh��)��,���F(tu��n)�(du��)ؓ(f��)؟(z��)��,�����ں���늼��g(sh��)���̌�(sh��)�(y��n)�����Ώ��Ͻ��ڱ�ʾ�����ں����������t(y��)�W(xu��)�����߂�Ī�(d��)��(y��u)��(sh��)���Y(ji��)�����M(j��n)���⼼�g(sh��),������f(xi��)�{(di��o)��(chu��ng)��,�������鰩�Y���ߵ��ί��ṩ�µ�˼·��ҕҰ��ԓ�о��ijɹ��R���D(zhu��n)��,�����ӿ�����������Y���M(j��n)��,��
��ʽ�壺��������ˮ���z ���ڰ��Y���g(sh��)�c���f(xi��)ͬ�ί��̈́�(chu��ng)���ޏ�(f��)
�Ї�(gu��)�ƌW(xu��)Ժ�������M(j��n)���g(sh��)�о�Ժ�о��T���W(xu��)�h���������c��۳��д�W(xu��)�����섦���Ⱥ���,���ɹ��Ƃ�����ں��{��Ƭ�Ľ��t��푑�(y��ng)����ˮ���z,�������ڰ��Y���g(sh��)�c���f(xi��)ͬ�ί��̈́�(chu��ng)���ޏ�(f��)��
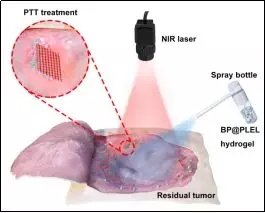
��������ˮ���z�[���ί�ʾ��D
�о��F(tu��n)�(du��)������ɽ���ĺ��{��Ƭ�c�ض�푑�(y��ng)ˮ���z�M(j��n)�Џ�(f��)��,���Ƃ���һ�N�ɇ�Ϳ��������ˮ���z����Ƅ�,�����׃�(y��u)���Ľ��t����Ч��(y��ng)��ʹˮ���z�ڂ��ڱ���Ѹ�����z����������Y���g(sh��)�ί���Ě����[���M��,���ҿ��Ԛ�����(x��)��������ڸ�Ⱦ,��ͬ�r(sh��)������ˮ���z���������õ�����ɽ����Ժ�����������,���ڹ���ί�֮����Ծ�������,����ȫ�ش��x���w�⡣�@�N������ˮ���z�ijɹ��аl(f��),���������Ƅ�(d��ng)����ί����g(sh��)�Č�(sh��)�H�R����(y��ng)��,���о��F(tu��n)�(du��)����Ո(q��ng)���P(gu��n)�l(f��)�����������e�O�Ƅ�(d��ng)���(b��o)���P(gu��n)�R����(y��ng)���S��,�������Ռ��������R��,��
��ʽ�������ھ۶�Ͱ����Եĺ��{�oˎϵ�y(t��ng) �����[���Ķ�ģʽ�f(xi��)ͬ�ί�
��ɽ��W(xu��)ˎ�W(xu��)Ժ�����ڣ�÷�ֽ����n�}�M�O(sh��)Ӌ(j��)��һ�N��(ji��n)��Ч�ķ�����ԓ�(xi��ng)�����ں��ױ������һ�ӷ����ľ۶�Ͱ�Ĥ��Polydopamine, PDA��,���γ�һ�N���{���z�ҡ��Y(ji��)��(g��u),���۶�Ͱ��������õ����������ԣ�������Ч���x�����ˮ�c���{��Ƭ�Ľ��|,���Ķ�����䷀(w��n)����,�����⣬�۶�Ͱ������������õĹ��Ч��(y��ng),����˾۶�Ͱ��İ��������M(j��n)һ������(qi��ng)����ˎ���d�wϵ�y(t��ng)�Ĺ��Ч��(y��ng),���ڴ˻��A(ch��)�ϣ������ˆT��С�ɔ_RNA��siRNA���͏V�V�Կ���ˎ�������ǣ�DOX��ؓ(f��)�d���ˡ��{���z�ҡ���(n��i)��,�����ھ۶�Ͱ�����������˰�����F(tu��n)�����m���w��Aptamer, Apt��,���Ƃ���һ�N�������������ί�����ί���һ�w�Ķ�ܰ���{���dˎƽ�_(t��i),��Ŀǰ,��ԓ�о��ڄ�(d��ng)���w��(n��i)��(sh��)�(y��n)��ȡ��ͻ�ƣ��������ٰ�ģ�͵���������ȡ�������õ��[���ί�Ч����
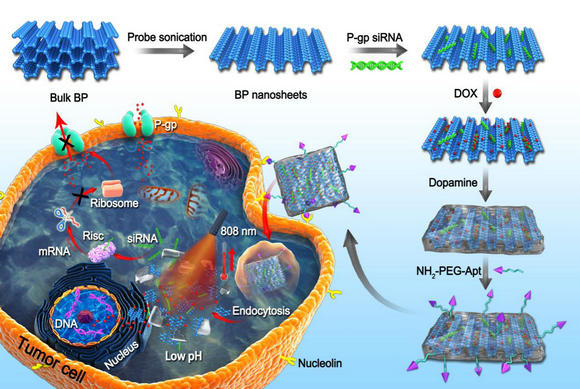
���ھ۶�Ͱ����Եĺ��{�oˎϵ�y(t��ng)�����[���Ķ�ģʽ�f(xi��)ͬ�ί�
ԓ�о��˷��˺��������dˎƽ�_(t��i)���|(zh��)����(w��n)����ȱ�c(di��n),����������(qi��ng)������Ч��(y��ng),��ͬ�r(sh��)�������õ����������ԣ��ڰ��Y�Ķ�ģʽ�C���ί�������Н��ڑ�(y��ng)��ǰ��,��
��ʽ�ߣ����������ˎ�ﯟ����Bioactive Phosphorus-based Therapy��
�Ї�(gu��)�ƌW(xu��)Ժ�������M(j��n)���g(sh��)�о�Ժ�о��T���W(xu��)�h�n�}�M���_(k��i)�l(f��)��Ȼ������Լ{����ˎ���I(l��ng)��ȡ�����M(j��n)չ,�������һ�N���ں��ױ���������Եİ��Y�����ׯ��¼��g(sh��)���о��l(f��)�F(xi��n),�����ڰ���(x��)����ʢ�İ�������,���^��Ĵ��x���ʺ��^��(qi��ng)���������������{��Ƭ�ױ�����(x��)��ͨ�^(gu��)�������ô����zȡ,���������ٽ���,���ڰ���(n��i)�a(ch��n)������������x�ӡ��@һ�^(gu��)�̌�(d��o)�°���(x��)����(n��i)�h(hu��n)����׃,������G2/M�����,���Ķ���Ч���ư���(x��)����ֳ����ֳ���ƺ�İ���(x��)���M(j��n)һ��ͨ�^(gu��)���������ɵ�;���M(j��n)�����(x��)������,������(du��)��������(x��)��,���������^���Ĕzȡ���Ժʹ��x���ʣ����Ĕzȡ���ҽ��⾏��,���Ķ������˺ܸߵ�����������,��
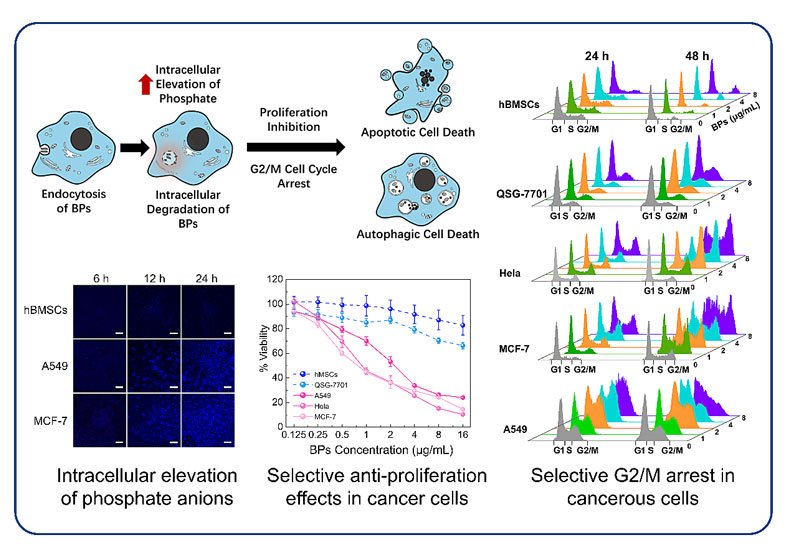
���������ˎ�ﯟ��
����ļ�(x��)���̈́�(d��ng)�(sh��)�(y��n)���������{��Ƭչ�F(xi��n)���dz���(y��u)���Ŀ��[����Ч,���䌦(du��)����(x��)�����x���Ԛ��������h(yu��n)��(y��u)�ڂ��y(t��ng)����ˎ�ﰢù�أ�DOX��,���о��F(tu��n)�(du��)���@һԴ�Ժ�����Ȼ������Եİ���(x��)���x���Ԛ������÷Q�顰���������ˎ�ﯟ����Bioactive Phosphorus-based Therapy��������(ji��n)�Q�������ׯ� ��BPT����,��ԓ�о����Hչʾ�˺����ڼ{����ˎ���_(k��i)�l(f��)�I(l��ng)��ľ�ǰ��,��ͬ�r(sh��)Ҳ��ʾ�˼{�ײ������[���ί��о��I(l��ng)����·������W(xu��)�h��B�f(shu��),���M(j��n)һ���Ļ��w��(sh��)�(y��n)�о������_(k��i)չ,�������x�����Ƴ�ˎ��߀��Ҫ���L(zh��ng)�r(sh��)�g��
�Y�ρ�(l��i)Դ���п�Ժ,�����A��W(xu��)�پW(w��ng),�����ϴ�W(xu��)�پW(w��ng)�����ڴ�W(xu��)�پW(w��ng),�������˵�
���Ї�(gu��)���w�W(w��ng)������/��̣�


















